4 types de liaisons chimiques
Atomes ont tendance à se ranger dans les modèles les plus stables possibles, ce qui signifie qu'ils ont tendance à remplir ou remplir leurs orbites des électrons ultrapériphériques. Ils se joignent à d'autres atomes pour faire exactement cela. La force qui maintient les atomes ensemble dans les collections connues sous le nom molécules
que l'on appelle un liaison chimique. Il existe deux types principaux et secondaires de certains types de liaisons chimiques: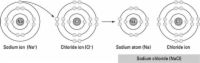
 Agrandir
AgrandirLiaison ionique
Cette liaison chimique implique un transfert d'un électron, donc les gains d'un atome un électron alors un atome perd un électron. Un des ions résultant porte une charge négative (anion), et l'autre ion porte une charge positive (cations). Parce que des charges opposées attirent, la liaison des atomes ensemble pour former une molécule.
 Agrandir
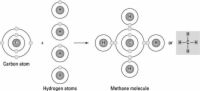
AgrandirUne liaison covalente
Le lien le plus commun dans les molécules organiques, une liaison covalente implique le partage d'électrons entre deux atomes. La paire d'électrons partagés constitue une nouvelle orbite qui se prolonge autour des noyaux de deux atomes, production d'une molécule. Il existe deux types secondaires de liaisons covalentes qui sont pertinentes à la biologie - liaisons polaires et des liaisons hydrogène.
 Agrandir
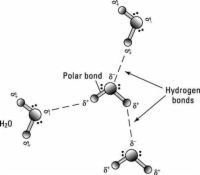
AgrandirLien Polar
Deux atomes liés par une liaison covalente peuvent exercer différentes attractions pour les électrons dans la liaison, produisant une charge inégalement répartie. Le résultat est connu en tant que liaison polaire, un cas intermédiaire entre la liaison ionique et covalente, avec une extrémité de la molécule chargée négativement légèrement et l'autre extrémité légèrement chargée positivement.
Ces légers déséquilibres dans la répartition de charge sont indiqués sur la figure par des symboles de delta minuscules avec un exposant de charge (+ ou -). Bien que la molécule résultante est neutre, à des distances proches de la distribution de charge inégale peut être important. L'eau est un exemple de molécule- polaire la fin de l'oxygène a une légère charge positive tandis que les extrémités d'hydrogène sont légèrement négative. Polarité explique pourquoi certaines substances se dissolvent facilement dans l'eau et d'autres pas.
Liaison hydrogène
Parce qu'ils sont polarisée, deux H adjacente2O (eau) molécules peuvent former une liaison connu comme un liaison hydrogène, où le (électronégatif) un atome d'hydrogène H d'une2Molécule d'O est attiré électrostatiquement à la (électropositif) un atome d'oxygène d'une molécule d'eau adjacent.
Par conséquent, les molécules d'eau se rejoignent de manière transitoire dans un réseau de liaisons hydrogène. Les liaisons hydrogène ont seulement environ 1/20 de la force d'une liaison covalente, mais même cette force est suffisante pour affecter la structure de l'eau, la production de plusieurs de ses propriétés uniques, comme la tension de surface élevée, la chaleur spécifique, et la chaleur de vaporisation. Les liaisons hydrogène sont importants dans de nombreux processus biologiques, tels que dans la réplication et définissant la forme de molécules d'ADN.




