Structure atomique: le modèle de la mécanique quantique
Deux modèles de structure atomique sont en usage aujourd'hui: le modèle Bohr et le modèle de la mécanique quantique. Le modèle de la mécanique quantique est basée sur les mathématiques. Bien qu'il soit plus difficile à comprendre que le modèle de Bohr, il peut être utilisé pour expliquer les observations faites sur des atomes complexes.
Sommaire
Un modèle est utile car elle vous aide à comprendre ce qui se observée dans la nature. Il est pas rare d'avoir plus d'un modèle représenter et aider les gens à comprendre un sujet particulier.
Le modèle mécanique quantique est basée sur théorie des quanta, qui dit importe également des propriétés associées aux vagues. Selon la théorie quantique, il est impossible de connaître la position exacte et l'élan d'un électron dans le même temps. Ceci est connu comme la Principe d'Incertitude.
Le modèle mécanique quantique de l'atome utilise des formes complexes de orbitales (parfois appelée nuages d'électrons), Les volumes de l'espace dans lequel il y a probable être un électron. Ainsi, ce modèle est basé sur la probabilité plutôt que la certitude.
Quatre numéros, appelés nombre quantique, ont été introduits pour décrire les caractéristiques d'électrons et de leurs orbitales:
Nombre quantique principal: n
Le moment cinétique nombre quantique: l
Magnetic nombre quantique:
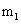
Spin nombre quantique:
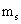
Le nombre quantique principal
Le nombre quantique principal n décrit la distance moyenne de l'orbitale du noyau - et l'énergie de l'électron dans un atome. Elle peut avoir des nombres entiers positifs (nombre entier) valeurs: 1, 2, 3, 4, et ainsi de suite. Plus la valeur de n est élevée, plus l'énergie et plus la orbital. Les chimistes appellent parfois les orbitales couches électroniques.
Le nombre quantique de moment angulaire
Le nombre quantique de moment angulaire l décrit la forme de l'orbitale, et la forme est limitée par le nombre quantique principal n: Le nombre quantique de moment angulaire l peut avoir des valeurs entières positives de 0 à n-1. Par exemple, si la valeur de n est 3, les trois valeurs sont autorisées pour l: 0, 1, 2 et.
La valeur de l définit la forme de l'orbite, et la valeur de n définit la taille.
Orbitales qui ont la même valeur de n, mais des valeurs différentes de l sont appelés sous-couches. Ces sous-couches sont donnés différentes lettres pour aider les chimistes les distinguent les uns des autres. Le tableau suivant montre les lettres correspondant aux différentes valeurs de l.
| Valeur de L (sous-couche) | Lettre |
|---|---|
| 0 | s |
| 1 | p |
| 2 | ré |
| 3 | F |
| 4 | g |
Lorsque les chimistes décrivent un sous-shell notamment dans un atome, ils peuvent utiliser à la fois la valeur de n et le sous-shell lettre - 2p, 3d, et ainsi de suite. Normalement, une valeur de sous-couche de 4 est le plus grand besoin pour décrire un sous-shell particulier. Si jamais les chimistes ont besoin d'une plus grande valeur, ils peuvent créer des numéros de sous-shell et des lettres.
La figure suivante montre les formes des S, P, et orbitales d.
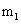
Comme indiqué dans la rangée du haut de la figure (a), il ya deux de orbitales - un pour le niveau d'énergie 1 (1s) et l'autre pour le niveau d'énergie 2 (2s). Les orbitales s sont sphériques avec le noyau au centre. Notez que l'orbitale 2s est plus grand diamètre que l'orbitale 1s. En gros atomes, les orbitales 1s est niché à l'intérieur des 2s, tout comme le 2p est niché à l'intérieur du 3p.
La deuxième ligne de la figure (b) montre les formes des orbitales p, et les deux dernières lignes (c) montrent les formes des orbitales d. Notez que les formes deviennent progressivement plus complexe.
Le nombre quantique magnétique
Le nombre quantique magnétique est désigné comme:
Ce numéro décrit comment les différents orbitales sont orientés dans l'espace. La valeur de ce nombre dépend de la valeur de l. Les valeurs autorisées sont des entiers de -l de 0 à +l. Par exemple, si la valeur de l = 1 (p orbitale), vous pouvez écrire trois valeurs pour ce numéro: -1, 0, et +1. Cela signifie qu'il y a trois sous-couches de p différentes pour une orbital particulier. Les sous-couches ont la même énergie, mais des orientations différentes dans l'espace.
La deuxième rangée (b) de la figure montre comment les orbitales p sont orientés dans l'espace. Notez que les trois orbitales p magnétiques correspondent aux valeurs de nombre quantique de -1, 0, 1, et orientées selon les x, y et z axes.
Le nombre quantique de spin
Le quatrième et dernier nombre quantique est le nombre quantique de spin, désigné comme:
Ce numéro décrit la direction l'électron tourne dans un champ magnétique - soit dans un sens ou. Seules deux valeurs sont autorisées: +1/2 ou -1/2. Pour chaque sous-shell, il ne peut y avoir que deux électrons, une avec un spin +1/2 et un autre avec un spin de -1/2.





