Structure atomique: le modèle de Bohr
Il existe deux modèles de structure atomique en usage aujourd'hui: le modèle Bohr et le modèle de la mécanique quantique. De ces deux modèles, le modèle de Bohr est simple et relativement facile à comprendre.
Un modèle est utile car elle vous aide à comprendre ce qui se observée dans la nature. Il est pas rare d'avoir plus d'un modèle représenter et aider les gens à comprendre un sujet particulier.
Avez-vous déjà acheté des cristaux de couleurs pour votre foyer - à faire flammes de différentes couleurs? Ou avez-vous déjà regardé les feux d'artifice et se demande où les couleurs sont venus?
Couleur provient de différents éléments. Si vous saupoudrez de sel de table sur un feu, vous obtenez une couleur jaune. Les sels qui contiennent du cuivre donnent une flamme bleu-verdâtre. Et si vous regardez les flammes à travers une spectroscope, un instrument qui utilise un prisme pour briser la lumière en ses différentes composantes, vous voir un certain nombre de lignes de différentes couleurs. Ces lignes de couleur distinctes constituent une spectre de ligne.
Niels Bohr, un scientifique danois, a expliqué ce spectre de la ligne tout en développant un modèle de l'atome:
Le modèle de Bohr montre que les électrons dans les atomes sont sur des orbites de différentes énergies autour du noyau (pensent de planètes en orbite autour du soleil).
Bohr a utilisé le terme niveaux d'énergie (ou coquilles) Pour décrire ces orbites de différentes énergies. Il a dit que l'énergie d'un électron est quantifié, électrons sens peut avoir un niveau d'énergie ou d'une autre, mais rien entre les deux.
Le niveau d'énergie d'électrons est appelé occupe normalement sa niveau zéro. Mais il peut se déplacer à une énergie plus élevé, niveau moins stable, ou la coquille, en absorbant l'énergie. Cette énergie plus élevé, état moins stable est appelé les électrons de état excité.
Après ça fait d'être excité, l'électron peut revenir à son état original du sol en libérant l'énergie qu'il a absorbé, comme le montre le schéma ci-dessous.
Parfois, l'énergie libérée par les électrons occupe la partie de la spectre électromagnétique (la gamme de longueurs d'onde d'énergie) que les humains détectent la lumière visible. De légères variations dans la quantité de l'énergie sont considérées comme lumière de différentes couleurs.
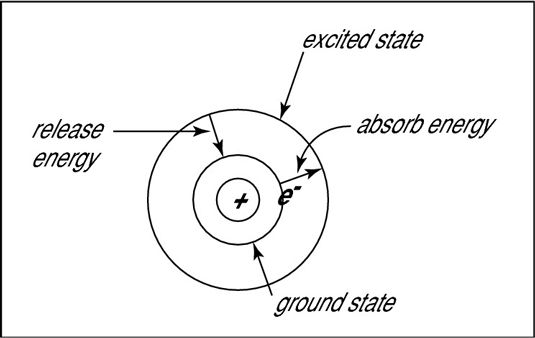 États fondamental et excité dans le modèle de Bohr.
États fondamental et excité dans le modèle de Bohr.
Bohr a constaté que plus un électron est le noyau, le moins d'énergie dont il a besoin, mais le plus loin, il est, plus l'énergie dont il a besoin. Donc Bohr numéroté les niveaux d'énergie de l'électron. Plus le nombre de niveau de l'énergie, l'électron est plus loin du noyau - et plus l'énergie.
Bohr a également constaté que les différents niveaux d'énergie peuvent contenir des numéros d'électrons différents: niveau d'énergie 1 peut contenir jusqu'à 2 électrons, niveau d'énergie 2 peut contenir jusqu'à 8 électrons, et ainsi de suite.
Le modèle de Bohr fonctionne bien pour les atomes très simples tels que l'hydrogène (qui a 1 électron), mais pas pour les atomes plus complexes. Bien que le modèle de Bohr est encore utilisé aujourd'hui, notamment dans les manuels scolaires élémentaires, un modèle plus sophistiqué (et complexe) - le modèle mécanique quantique - est utilisé beaucoup plus fréquemment.



