Calculer réactifs limitants, l'excès de réactifs et de produits dans les réactions chimiques
Dans les réactions chimiques de la vie réelle, convertit pas tous les réactifs présents dans le produit. Plus généralement, un réactif est totalement utilisée, et d'autres sont laissés dans l'excès, peut-être réagir un autre jour. Le réactif qui est utilisé en place est le réactif limitant.
Les chimistes ont besoin de savoir qui réactif se déroulera d'abord, parce que cette information leur permet de déduire la quantité de produit et l'excès de réactif qu'ils peuvent attendre, sur la base de la quantité de réactif limitant qu'ils ont mis dans la réaction.
Dans toute réaction chimique, vous pouvez tout simplement choisir un réactif comme un candidat pour le réactif limitant, calculer le nombre de moles de ce réactif que vous avez, et ensuite calculer combien de grammes de l'autre réactif vous aurez besoin de réagir à la fois à l'achèvement. Vous découvrirez l'une des deux choses. Soit vous avez un excès du premier réactif, ou si vous avez un excès du second réactif. Celui que vous avez en excès est la excès de réactif. Celui qui ne dépasse pas est le réactif limitant.
Ici'un exemple. Dites que vous menez une expérience où l'ammoniac réagit avec l'oxygène pour produire du monoxyde d'azote et de l'eau liquide:
Afin de trouver les réactifs limitants, l'excès de réactifs et de produits dans cette réaction, vous devez faire ce qui suit:
Équilibrer l'équation.
Déterminer si le réactif de limitation 100 g de chaque réactif sont présents au début de la réaction.
Identifier l'excès de réactif, ainsi que le nombre de grammes de l'excès de réactif resteront lorsque la réaction atteint son terme.
Calculer combien de grammes de chaque produit seront produites si la réaction va à l'achèvement.
Donc, voici la solution:
Équilibrer l'équation.
Avant toute chose, vous devez avoir une équation équilibrée de la réaction. Ne perdez pas de bonne pensée sur une équation déséquilibrée. La forme équilibrée de l'équation donnée est

Deux candidats, NH3 et O2, en lice pour le statut de réactif limitant. On commence par 100 g de chacune, ce qui correspond à un certain nombre de moles de chaque. En outre, vous pouvez dire à partir des coefficients dans l'équation équilibrée Cette réaction nécessite 4 moles d'ammoniac pour chaque 5 mole de gaz d'oxygène.
Déterminer si le réactif de limitation de l'ammoniaque 100 g et 100 g d'oxygène sont présents au début de la réaction.
Pour trouver le réactif limitant, il vous suffit d'effectuer une masse à la masse (grammes à gramme) calcul à partir de l'un des réactifs à l'autre. Cela vous permet de voir ce qui fonctionne réactif en premier. Vous pouvez commencer avec soit réactif et convertir en masse de l'autre. Dans cet exemple, nous allons commencer avec de l'ammoniac:
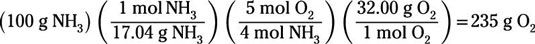
Le calcul montre que vous auriez besoin de 235 g de gaz d'oxygène pour réagir complètement avec 100 g d'ammoniac. Mais vous avez seulement 100 g d'oxygène. Vous serez à court d'oxygène avant de manquer de l'ammoniac, de sorte l'oxygène est le réactif limitant.
Identifier l'excès de réactif, ainsi que le nombre de grammes de l'excès de réactif resteront lorsque la réaction atteint son terme.
Pour calculer combien de grammes d'ammoniac sera laissé à la fin de la réaction, on suppose que tous les 100 g d'oxygène réagit:
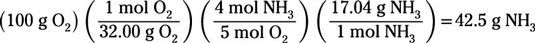
Ce calcul montre que 42,5 g de l'original 100 g d'ammoniac va réagir avant que le réactif limitant est dépensée. Ainsi, l'excès de réactif est de l'ammoniac, et 57,5 g d'ammoniac restera lorsque la réaction atteint achèvement (juste soustraire 42,5 à partir de 100).
Calculer combien de grammes de monoxyde d'azote et de l'eau seront produites si la réaction va à l'achèvement.
Ce problème demande combien d'un produit est fabriqué. Pour ce calcul, vous devez commencer avec le réactif limitant. Pour déterminer le nombre de grammes de monoxyde d'azote qui sont générés par la réaction complète de l'oxygène, commencer avec l'hypothèse que tous les 100 g de l'oxygène réagit:

Ainsi, Sera produit 75 g de monoxyde d'azote.
Encore une fois, on suppose que tous les 100 g de l'oxygène réagit afin de déterminer combien de grammes d'eau sont produits:
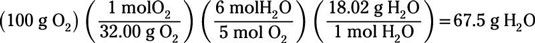
Vous trouvez que 67.5g d'eau ne sera produit.




