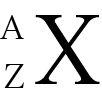Dans la liaison, les atomes perdent, gain, ou partagent des électrons afin d'avoir le même nombre d'électrons que le gaz noble qui est le plus proche sur le tableau périodique. Ioniques, covalentes et liaisons métalliques sont formés par des combinaisons de métaux et non-métaux.
Métal + non métalliques = liaison ionique
Non métalliques + non métalliques = liaison covalente
Métal + métal = liaison métallique
Lorsque deux éléments se livrer à une liaison ionique, un ou plusieurs électrons sont transférés à partir du métal à la non-métal, formant ions (atomes chargés). Le métal, ayant perdu un ou plusieurs électrons, forme une cation, un ion avec une charge-positif, le non-métal, ayant gagné un ou plusieurs électrons, devient un anion, un ion avec une charge négative.
Lorsque deux éléments forment une liaison covalente, une ou plusieurs paires d'électrons sont partagés entre ces deux éléments. En liaison métallique, qui se produit dans les métaux (soit un métal pur ou d'un alliage de deux ou plusieurs métaux), la valence (coquille externe) électrons sont reversés à une «mer d'électrons."
Chimie Concepts: niveaux d'énergie et Orbitals
A beaucoup de la chimie est expliquée par le partage et l'échange d'électrons entre les atomes. Comprendre comment les électrons sont disposés dans un atome est un bloc de construction de Chem I.
Les électrons dans un atome sont contenus dans les niveaux d'énergie spécifiques (1, 2, 3, et ainsi de suite) qui sont des distances différentes du noyau. Plus le nombre du niveau d'énergie, plus elle est dans le noyau. Les électrons qui sont dans le haut niveau d'énergie sont appelés valence électrons. Au sein de chaque niveau d'énergie est un volume de l'espace où les électrons spécifiques sont susceptibles de se trouver. Ces espaces, dits orbitales, sont de formes différentes, désignées par une lettre (s, p, d, f, g). (Dans la plupart des cas, seuls les électrons contenus dans les S et P orbitales sont considérées comme des électrons de valence.) Les électrons cherchent le niveau d'énergie le plus bas possible.
Le motif d'électrons remplissage suivant indique comment remplir les électrons dans les niveaux d'énergie. Sachant ce modèle est utile dans de nombreux aspects de la chimie, y compris la prédiction de la situation de la liaison d'un atome particulier dans la prédiction et de la géométrie d'un composé covalent.
Electron motif de remplissage: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4F, 5d, 6p, 7s, 5f
Creuser le concept de la mole en chimie
La taupe (abbreviate mol et parfois appelée Avogadro's numéro) Est un numéro de conversion qui permet un chimiste ou un étudiant de chimie pour passer du monde microscopique des atomes, des ions et molécules au monde macroscopique de grammes, en kilogrammes, et des tonnes. La taupe est utilisé dans stœchiométrie de la réaction de prédire combien de produit peut être faite à partir d'une certaine quantité de réactif réactif ou combien est nécessaire pour produire une certaine quantité de produit.
Si vous connaissez les particules, les taupes, ou en grammes d'une substance, vous pouvez calculer les deux autres mesures à l'aide de l'équation suivante:
1 mole = 6.022 x 1023 particules / mol = poids de la formule exprimée en grammes
Identifier isotopes travers Représentations
Dans Chem I, vous pourriez avoir à identifier jesotopes, qui sont des atomes d'un même élément qui ont des nombres différents de neutrons. La représentation suivante vous permet d'identifier un isotope d'un élément spécifique. Il est largement utilisé dans l'équilibre des réactions nucléaires.
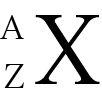
X = symbole de l'élément
Z = numéro atomique (nombre de protons)
A = nombre de masse (nombre de protons + nombre de neutrons)
Conversion des mesures communes pour la chimie
Pour réussir dans votre classe Chem I, vous devez avoir une bonne compréhension des mesures de la chimie de base et la façon de les convertir d'une mesure à l'autre. Voici quelques conversions importantes de température, la taille, et la pression ainsi que des préfixes métriques à mémoriser pour votre classe de chimie:
Conversions de température:
Anglais / conversions métriques:
= 1 à 2,54 cm
£ 1 = 454 g
1 qt = 0,946 L
Conversion de pression:
Préfixes métriques communes:
millimètres = 0,001
centi- = 0,01
kilo- = 1000
La chimie de base des acides et les bases
Un grand nombre de chimie vous oblige à comprendre la différence entre les acides et les bases. Un acide une substance qui est un H don+ ion à d'autres espèces chimiques appelés une base. UN base est une substance qui accepte (combine avec) un H+ ion.
Si vous avez besoin de connaître la concentration de l'H+ ions en solution, vous pouvez le faire en représentant le H+ molarité, [H+]. Une autre façon de représenter le H+ concentration est le pH, qui est le logarithme négatif de la H+ molarité. L'équation suivante montre cette relation mathématique ainsi que la façon de calculer le H+ la molarité donnée pH:
pH = -log [H+] - [H+] = 10-pH
La loi des gaz combinée et loi des gaz parfaits
Lorsque l'on étudie les propriétés des gaz, vous devez connaître les relations entre les variables volume (V), pression (P), Température Kelvin (T), et la quantité en moles (n) de sorte que vous pouvez calculer les informations manquantes (P, V, T, ou n) Et résoudre les problèmes de stœchiométrie de la réaction. Bien que les paires de variables ont des relations individuelles, les deux lois les plus importantes et les plus utiles sont le gaz la loi combinée à gaz et le loi des gaz parfaits:
| Loi des gaz combinée | (P1V1) /T1= (P2V2) /T2 | (T doit être en Kelvin) |
| Loi des gaz parfaits | PV = nRT | (R = 0,0821 L atm / K.mol) |