Les liaisons covalentes: types de formules chimiques
Il existe plusieurs types de formules chimiques que vous pouvez utiliser pour représenter les liaisons chimiques. Ceux-ci comprennent les formules empiriques, moléculaire (ou vrai
Sommaire
On peut prévoir la formule d'un composé ionique sur la base de la perte et de gain d'électrons, pour accéder à une configuration de gaz noble. Cependant, vous ne pouvez vraiment pas faire ce type de prédiction avec des composés covalentes, parce qu'ils peuvent se combiner à de nombreux égards, et de nombreux différents composés covalents possibles peuvent en résulter.
La plupart du temps, vous devez connaître la formule de la molécule vous êtes étudiant. Mais vous pouvez avoir plusieurs différents types de formules, et chacune donne un montant légèrement différente de l'information.
Formule empirique: seulement les éléments
La formule empirique indique les différents types d'éléments dans une molécule et le meilleur rapport entier de chaque type d'atome de la molécule. Par exemple, supposons que vous avez un composé avec la formule empirique:
Trois types différents d'atomes sont dans le composé, C, H et O, et ils sont dans le meilleur rapport entier de 2 à C 6 H à 1 O. Ainsi, la formule réelle (appelé le formule moléculaire ou vrai formula) peut être l'un quelconque des éléments suivants, ou un autre multiple de 2: 6: 1.
Moléculaire ou vraie formule: A l'intérieur des numéros
La formule moléculaire, ou vraie formule, vous indique les types d'atomes de carbone dans le composé et le nombre réel de chaque atome.
Vous pouvez déterminer, par exemple, que la formule empirique suivante est en fait la formule moléculaire est, elle aussi, ce qui signifie qu'il y a en fait deux atomes de carbone, de six atomes d'hydrogène, et un atome d'oxygène dans le composé:
Pour les composés ioniques, cette formule est assez pour identifier pleinement le composé, mais il ne suffit pas pour identifier des composés covalentes. Pour écrire une formule qui signifie le composé exact que vous avez à l'esprit, vous souvent devez écrire la formule de structure au lieu de la formule moléculaire.
Formule développée: Ajouter le motif de collage
La formule structurale montre les éléments dans le composé, le nombre exact de chaque atome dans le composé, et le motif de liaison pour le composé. La formule d'électrons-point et formule Lewis sont des exemples de formules structurelles.
Regardez les formules de Lewis présentés dans la figure suivante.
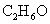
Les deux composés sur la figure ont deux atomes de carbone, de six atomes d'hydrogène, et un atome d'oxygène. La différence est dans la façon dont les atomes sont liés, ou ce qui se lié à ce. Ce sont deux composés distinctes, avec deux ensembles totalement différents de propriétés:
La formule sur la gauche représente l'éther diméthylique. Ce composé est utilisé dans des unités de réfrigération et est hautement inflammable.
La formule sur la droite représente alcool éthylique, la variété de la consommation d'alcool.
Il suffit de savoir la formule moléculaire ne suffit pas de faire la distinction entre les deux composés.
Les composés qui ont la même formule moléculaire mais des structures différentes sont appelés isomères de l'autre. Pour identifier le exact composé covalente, vous devez sa formule structurelle.





