Comment température, la concentration, et des catalyseurs influent sur les taux de réaction chimique
Les chimistes sont capricieux, types bricoler. Ils veulent généralement de modifier les taux de réaction en fonction de leurs propres besoins. Que peut influer sur les taux, et pourquoi? Température, la concentration, et des catalyseurs influent sur les taux comme suit:
Les vitesses de réaction ont tendance à augmenter avec la température. Cette tendance résulte du fait que les réactifs doivent entrer en collision avec un autre pour avoir la chance de réagir. Si les réactifs entrent en collision avec la bonne orientation et avec suffisamment d'énergie, la réaction peut se produire. Donc, plus le nombre de collisions et de plus l'énergie de ces collisions, réagir plus effective. Une augmentation de la température correspond à une augmentation de l'énergie cinétique moyenne des particules dans un mélange de réaction - les particules se déplacent plus rapidement, plus fréquemment et entrer en collision avec plus d'énergie.
L'augmentation de concentration tend à augmenter la vitesse de réaction. La raison de cette tendance a aussi à voir avec les collisions. Une concentration plus élevée signifie plus de particules que les réactifs sont plus rapprochés, de sorte qu'ils subissent plus de collisions et d'avoir une plus grande chance de réagir. L'augmentation de la concentration des réactifs peut signifier la dissolution de plusieurs de ces réactifs en solution.
Certains réactifs ne sont pas complètement dissous, mais viennent dans les grandes, les particules non dissoutes. Dans ces cas, les particules plus petites conduisent à des réactions plus rapides. Les particules plus petites exposent une plus grande surface, ce qui rend une quantité plus importante de la particule disponible pour la réaction.
Les catalyseurs d'augmenter les vitesses de réaction. Catalyseurs ne deviennent eux-mêmes ne changent pas chimiquement, et ils ne modifient pas la quantité de produit d'une réaction peut éventuellement produire (la rendement). Un exemple de la petite enfance correspond ici. Quand vous apprenez à faire du vélo, vous pourriez obtenir une poussée de vos parents pour vous aider à y aller. Cependant, après cette poussée, le pédalage est entièrement à vous. Votre vitesse de pointe et de destination finale sont encore entièrement réglées par votre capacité à pédaler et d'orienter le vélo, mais cette poussée (le catalyseur) ont permis de vous lever pour accélérer plus rapidement.
Les catalyseurs peuvent fonctionner de nombreuses façons différentes, mais tous ces moyens ont à voir avec la baisse l'énergie d'activation, les réactifs de colline énergiques doivent grimper pour atteindre un état de transition, l'état de la plus haute énergie le long d'une voie de réaction. Énergies d'activation plus faibles signifient des réactions plus rapides. La figure montre une réaction schéma de progrès, la voie énergique qui réactifs doivent traverser pour devenir des produits.
Un schéma de progression de la réaction.
Par exemple, considérez la réaction suivante:
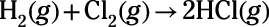
Si 1 mole de H2 réagit avec une mole de Cl2 pour former 2 moles de HCl, la réaction ne se produit plus rapidement dans un récipient de 5 L ou un récipient de 10 L? Elle se produit plus rapidement à 273 K ou 293 K? Pourquoi?
La réaction se produit plus rapidement dans le récipient de 5 L en raison de la concentration de molécules de réactif est supérieure quand ils occupent la plus faible volume. A des concentrations plus élevées, plus de collisions se produisent entre les molécules de réactif. A des températures plus élevées, les particules se déplacent avec une plus grande énergie, ce qui produit également d'autres collisions et les collisions de plus de force. Donc le réaction se produit plus rapidement à 293 K.
A propos Auteur
 Comment e1 réactions d'élimination se produisent
Comment e1 réactions d'élimination se produisent Réactions d'élimination sont souvent en concurrence avec des réactions de substitution. Comme dans les réactions de substitution, un mécanisme possible pour une réaction d'élimination est l'élimination du premier ordre, ou le mécanisme E1.…
 Comment équilibrer les réactions chimiques dans les équations
Comment équilibrer les réactions chimiques dans les équations Lorsque vous écrivez une équation pour une réaction chimique, les deux côtés de l'équation doivent équilibre - vous avez besoin du même nombre de chaque type d'élément sur les deux côtés. Si vous effectuez une réaction chimique et…
 Comment calculer réactions endothermique et exothermique
Comment calculer réactions endothermique et exothermique En calculant le changement d'enthalpie dans une réaction chimique, vous pouvez déterminer si la réaction est endothermique ou exothermique. Les réactions chimiques transforment la matière et de l'énergie. Bien que les équations chimiques…
 Comment calculer cinétique problèmes
Comment calculer cinétique problèmes L'étude de cinétique, la vitesse des réactions chimiques, est essentiel à l'étude de la chimie et est un thème majeur dans une classe de chimie II. Connaître les notions de cinétique peut aider votre compréhension des raisons pour…
 Comment calculer le rendement de pour cent dans une réaction chimique
Comment calculer le rendement de pour cent dans une réaction chimique Les chimistes ont à se préoccuper de combien complètement leurs réactifs réagissent pour former des produits. Pour comparer la quantité de produit obtenue à partir d'une réaction avec la quantité qui aurait dû être obtenu, ils utilisent…
 Comment effectuer des conversions à partir d'équations équilibrées taupe taupe
Comment effectuer des conversions à partir d'équations équilibrées taupe taupe Vous pouvez équilibrer une équation chimique en ajustant les coefficients qui précèdent réactifs et des produits composés dans l'équation. Après vous avez une équation équilibrée, vous pouvez utiliser les coefficients de construire…
 Comment prédire la solubilité sur la base de la température
Comment prédire la solubilité sur la base de la température Augmenter la température amplifie les effets de l'entropie d'un système. Parce que l'entropie d'un soluté est généralement augmentée quand il se dissout, la température augmente la solubilité augmente généralement - pour les solutés…
 Radioactivité et désintégration radioactive artificielle
Radioactivité et désintégration radioactive artificielle La radioactivité est la désintégration spontanée d'un noyau instable. Un noyau instable peut se briser en deux ou plusieurs autres particules avec la sortie d'une certaine énergie. Cette briser peut se produire dans un certain nombre de…
 Réactifs et des produits dans les réactions chimiques
Réactifs et des produits dans les réactions chimiques Dans une réaction chimique, les substances (éléments et / ou composés) appelés réactifs sont transformés en d'autres substances (composés et / ou des dits éléments) produits. Vous ne pouvez pas modifier un élément en un autre dans une…
 Comment les nanotechnologies maximise surface
Comment les nanotechnologies maximise surface La nature minuscule de nanoparticules résultats dans quelques caractéristiques utiles, comme une augmentation de la surface à laquelle d'autres matériaux peut se lier de manière à rendre pour les matériaux légers plus fortes ou plus. À…
 Nanoparticules de platine pour prévenir la pollution de l'air
Nanoparticules de platine pour prévenir la pollution de l'air Toute matière à l'échelle nanométrique est une nanoparticule. La recherche en nanotechnologie dans l'utilisation de nanoparticules de platine est prometteur pour réduire le coût de l'utilisation du platine dans les pots catalytiques et autres…
 Bases de la fission nucléaire
Bases de la fission nucléaire Le débat sur les centrales nucléaires a été en cours depuis un certain temps, avec des physiciens nucléaires et des législateurs semblables jetant autour des termes comme la fission nucléaire, la masse critique, et réaction en chaîne. Mais…
 Termes scientifiques utile de connaître pour l'épreuve de la science acte
Termes scientifiques utile de connaître pour l'épreuve de la science acte Les réponses aux questions Test Act sciences proviennent principalement de l'information dans les passages, mais à chaque fois dans un certain temps, vous rencontrerez une question qui vous oblige à évoquer un terme scientifique ou la règle que…
 Déterminer le sens des symboles, termes scientifiques, et des phrases pour le test de la science GED
Déterminer le sens des symboles, termes scientifiques, et des phrases pour le test de la science GED Le test GED science attend que vous soyez en mesure de “ de déterminer la signification des symboles, termes et expressions comme ils sont utilisés dans les présentations scientifiques ”. Cela signifie que vous devez connaître le…
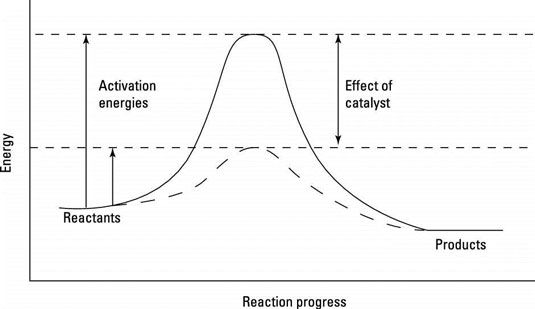 Un schéma de progression de la réaction.
Un schéma de progression de la réaction.





