Comment équilibrer les équations d'oxydo-réduction
Équations redox sont souvent si complexe que de jongler avec des coefficients d'équilibrer des équations chimiques ne fonctionne pas toujours bien. Les chimistes ont développé une méthode alternative (en plus de la méthode de degré d'oxydation) qui est appelé le ion-électron méthode (demi-réaction).
Dans le procédé d'ions électrons, l'équation d'oxydo-réduction asymétrique est converti à l'équation ionique et ensuite décomposé en deux demi-réactions - oxydation et de réduction. Chacun de ces demi-réactions est équilibré séparément et ensuite combinées pour donner l'équation ionique équilibrée.
Enfin, les ions spectateurs sont placés dans l'équation ionique équilibrée, la conversion de la réaction revenir à la forme moléculaire. Il est important de suivre les étapes avec précision et dans l'ordre indiqué. Sinon, vous ne pouvez pas réussir dans l'équilibrage des équations d'oxydoréduction.
L'exemple ci-dessous vous montre comment utiliser la méthode d'ions électrons pour équilibrer cette équation d'oxydoréduction:
Suivez ces étapes:
Convertir la réaction d'oxydoréduction déséquilibrée à la forme ionique.
Dans cette réaction, vous montrez l'acide nitrique dans la forme ionique, parce qu'il est un acide fort. Cuivre (II) est le nitrate soluble (indiqué par (aq)), Il est donc représenté dans sa forme ionique. Parce NO (g) et de l'eau sont des composés moléculaires, ils restent représenté sous la forme moléculaire:
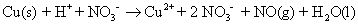
Si nécessaire, attribuer des numéros d'oxydation et ensuite écrire deux demi-réactions (oxydation et réduction) montrant les espèces chimiques qui ont eu leurs nombres d'oxydation changé.
Dans certains cas, il est facile de dire ce qui a été oxydée et reduced- mais dans d'autres cas, il est pas aussi facile. Commencer en passant par la réaction de l'exemple et l'attribution de numéros d'oxydation. Vous pouvez ensuite utiliser les espèces chimiques qui ont eu leurs nombres d'oxydation changé pour écrire vos demi-réactions asymétriques:
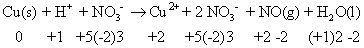
Le cuivre a changé son degré d'oxydation (0-2) et a donc de l'azote (de -2 à +2). Vos réactions asymétriques demi-sont:
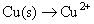
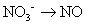
Équilibrer tous les atomes, à l'exception de l'oxygène et de l'hydrogène.
Il est une bonne idée d'attendre jusqu'à la fin pour équilibrer hydrogène et d'oxygène, il faut donc toujours un équilibre entre les autres atomes d'abord. Vous pouvez les équilibrer en bidouillant avec les coefficients. (Vous ne pouvez pas changer subscripts- vous ne pouvez ajouter coefficients.) Cependant, dans ce cas particulier, les deux atomes d'azote et de cuivre équilibre déjà, avec un chacun sur les deux côtés:
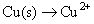
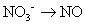
Équilibrer les atomes d'oxygène.
Comment conciliez-vous ces atomes dépend si vous faites affaire avec des solutions acides ou basiques:
Dans les solutions acides, prenez le nombre d'atomes d'oxygène nécessaires et d'ajouter que même nombre de molécules d'eau pour le côté qui a besoin d'oxygène.
Dans les solutions de base, ajouter
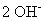
sur le côté qui a besoin d'oxygène pour chaque atome d'oxygène qui est nécessaire. Puis, de l'autre côté de l'équation, ajouter deux fois moins de molécules d'eau en tant que
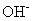
anions utilisés.
Équilibrer les atomes d'hydrogène.
Encore une fois, comment vous équilibrez ces atomes dépend de savoir si vous faites affaire avec des solutions acides ou basiques:
Dans les solutions acides, prenez le nombre d'atomes d'hydrogène nécessaires et d'ajouter que même nombre de
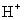
sur le côté qui doit hydrogène.
Dans les solutions de base, ajouter une molécule d'eau sur le côté qui doit hydrogène pour chaque atome d'hydrogène qui est nécessaire. Puis, de l'autre côté de l'équation, ajouter autant
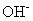
anions que les molécules d'eau utilisés.
Équilibrer la charge ionique sur chaque demi-réaction en ajoutant des électrons.
Les électrons doivent se retrouver sur des côtés opposés de l'équation dans les deux demi-réactions. Rappelez-vous que vous utilisez charge ionique, pas des nombres d'oxydation.
Oxydation:
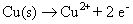
Réduction:
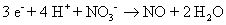
Équilibrer la perte d'électrons avec un gain d'électrons entre les deux demi-réactions.
Les électrons qui sont perdus dans la demi-réaction d'oxydation sont les mêmes électrons qui sont acquises dans la demi-réaction de réduction. Le nombre d'électrons perdus et gagnés doit être la même. Mais Étape 6 montre une perte de 2 électrons et un gain de 3.
Donc, vous devez ajuster les numéros en utilisant des multiplicateurs appropriés pour les deux demi-réactions. Dans ce cas, vous devez trouver le plus petit dénominateur commun entre 2 et 3. Il est 6, afin de multiplier la première demi-réaction par 3 et la deuxième demi-réaction par 2.
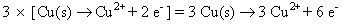
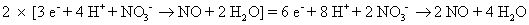
Ajouter les deux demi-réactions ensemble et annuler quoi que ce soit commun aux deux côtés.
Les électrons doivent toujours annuler (le nombre d'électrons devrait être la même sur les deux côtés).
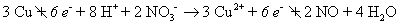
Convertir l'équation retour à la forme moléculaire en ajoutant les ions spectateurs.
Si il est nécessaire d'ajouter ions spectateurs d'un côté de l'équation, ajouter le même nombre de l'autre côté de l'équation.
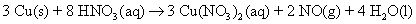
Assurez-vous que tous les atomes sont équilibrés, toutes les charges sont équilibrées (si vous travaillez avec une équation ionique au début), et tous les coefficients sont dans le bas rapport entier.
L'exemple équation est dans des conditions acides. Il n'y a rien à faire sur la demi-réaction impliquant le cuivre, car il n'y a pas d'atomes d'oxygène présents. Mais vous ne devez équilibrer les atomes d'oxygène dans la deuxième demi-réaction:
L'exemple équation est dans des conditions acides. Vous avez besoin d'équilibrer les atomes d'hydrogène dans la deuxième demi-réaction:
Les réactions qui ont lieu dans la base sont tout aussi facile, aussi longtemps que vous suivez les règles.






