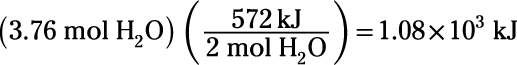Comment calculer réactions endothermique et exothermique
En calculant le changement d'enthalpie dans une réaction chimique, vous pouvez déterminer si la réaction est endothermique ou exothermique. Les réactions chimiques transforment la matière et de l'énergie. Bien que les équations chimiques habituellement la liste uniquement les composants de la matière d'une réaction, vous pouvez aussi envisager l'énergie thermique comme réactif ou produit. Lorsque les chimistes sont intéressés par le flux de chaleur au cours d'une réaction (et quand la réaction est effectuée à pression constante), on peut énumérer un changement d'enthalpie
à droite de l'équation de la réaction. À pression constante, le flux de chaleur est égale à la variation d'enthalpie:
Si la variation d'enthalpie affichée à une réaction est négative, alors que la réaction libère de la chaleur à mesure qu'il avance - la réaction est exothermique (exo = Out). Si la variation d'enthalpie énumérés pour la réaction est positive, alors que la réaction absorbe de la chaleur à mesure qu'il avance - la réaction est endothermique (endo- = En). En d'autres termes, les réactions exothermiques libèrent de la chaleur en tant que produit, et réactions endothermiques consommant de la chaleur en tant que réactif.
Le signe de la
vous indique la direction du flux de chaleur, mais qu'en est-il de l'ampleur? Les coefficients d'une réaction chimique représentent équivalents molaires, de sorte que la valeur indiquée pour le
se réfère à la variation d'enthalpie pour un équivalent molaire de la réaction. Voici un exemple:
Cette équation de réaction décrit la combustion du méthane, une réaction que vous pourriez attendre pour libérer la chaleur. Le changement d'enthalpie énumérés pour la réaction confirme cette attente: Pour chaque mole de méthane qui brûle, 802 kJ de chaleur est libérée. La réaction est fortement exothermique. Basé sur la stoechiométrie de l'équation, vous pouvez aussi dire que 802 kJ de chaleur est libérée pour chaque 2 moles de l'eau produite.
Donc changements réaction d'enthalpie (ou réaction "chaleurs") sont un moyen utile de mesurer ou de prédire les changements chimiques. Mais ils sont tout aussi utiles dans le traitement des changements physiques, telles que la congélation et la fonte, évaporation et de condensation, et d'autres. Par exemple, l'eau (comme la plupart des substances) absorbe la chaleur en fond (ou fusibles) Et comme il évapore. Voici les enthalpies molaires de ces changements:
Enthalpie molaire de la fusion:
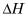
Enthalpie molaire de vaporisation:
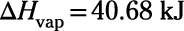
Les mêmes sortes de règles applicables à l'enthalpie changements énumérés pour les changements chimiques et les changements physiques. Voici un résumé des règles applicables à la fois:
La chaleur absorbée ou libérée par un procédé est proportionnel au nombre de moles de substance qui subissent ce processus. Par exemple, 2 moles de combustion libération de méthane deux fois autant de chaleur que 1 mole de la combustion du méthane.
Exécution d'un processus inverse produit le flux de chaleur de la même ampleur, mais de signe opposé que l'exécution du processus. Par exemple, le gel 1 mole d'eau libère la même quantité de chaleur qui est absorbée lorsque 1 mole d'eau fondu.
Try un exemple: voici une équation chimique équilibrée pour l'oxydation de l'hydrogène gazeux pour former de l'eau liquide, de même que la variation d'enthalpie correspondant:
Combien d'énergie électrique doivent être dépensés pour effectuer l'électrolyse de 3,76 mole d'eau liquide, la conversion de l'eau en gaz d'hydrogène et de gaz de l'oxygène?
Tout d'abord, reconnaître que le changement d'enthalpie est donnée pour l'inverse de la réaction d'électrolyse, de sorte que vous devez inverser son signe de -572 kJ à 572 kJ. D'autre part, rappellent que chaleurs de réaction sont proportionnels à la quantité de substance à réaction (2 moles de H2O dans ce cas), de sorte que le calcul est