Comment calculer les pressions partielles en utilisant la loi de Dalton
Quand les gaz se mélangent, chaque gaz individuel au sein du mélange apporte une pression partielle, et en ajoutant les pressions partielles donne la pression totale. Cette relation est résumée par Dalton's la loi des pressions partielles pour un mélange de gaz individuels:
Cette relation est logique si vous pensez à la pression en termes de théorie cinétique moléculaire. L'ajout d'un échantillon gazeux dans un volume particulier qui contient déjà d'autres gaz augmente le nombre de particules dans cet espace. Étant donné que la pression est fonction du nombre de particules entrant en collision avec les parois du récipient, ce qui augmente le nombre de particules augmente la pression proportionnellement.
Il n'y a pas une unité de pression spécifique, vous devez utiliser lorsque vous faites des problèmes avec partielles-pressions de l'équation de Dalton. Tant que les unités de pression pour tous les gaz sont les mêmes, vous êtes bon pour aller. Toutefois, si toutes les pressions indiquées ne sont pas dans les mêmes unités, puis certains conversion doit avoir lieu!
Ici'un exemple: Un chimiste conçoit une expérience pour étudier la chimie de l'atmosphère de la Terre primitive. Elle construit un appareil de combiner des échantillons purs des gaz volcaniques primaires qui composent les milliards de l'atmosphère d'années: le dioxyde de carbone, l'ammoniac et la vapeur d'eau. Si les pressions partielles de ces gaz sont 50 kPa, 80 kPa et 120 kPa, respectivement, ce qui est la pression du mélange résultant?
Cependant chimie atmosphérique difficile début de la Terre peut se révéler, ce problème particulier est simple. La loi de Dalton indique que la pression totale est simplement la somme des pressions partielles des composants gazeux:
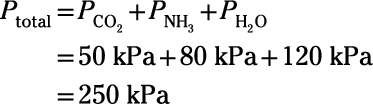
Ainsi, la pression du mélange résultant est 250 kPa.
Ici's un autre problème: Un chimiste ajoute de la poudre de zinc solide à une solution d'acide chlorhydrique pour initier la réaction suivante:
Le chimiste inverse un tube à essai et plonge la bouche ouverte dans le bécher de réaction pour recueillir le gaz d'hydrogène qui jaillit de la solution. La réaction se déroule à l'équilibre. A la fin de l'expérience, les niveaux d'eau dans le tube extérieur et le tube sont égales. La pression dans le laboratoire est 101,325 kPa et la température de tous les composants est de 298 K. La pression de vapeur d'eau à 298 K est de 3,17 kPa. Quelle est la pression partielle d'hydrogène gazeux piégé dans le tube?
Le système est venu d'équilibre, de sorte que l'intérieur du tube contient un mélange gazeux d'hydrogène gazeux et de vapeur d'eau. Parce que les niveaux d'eau à l'intérieur et l'extérieur du tube sont égaux, vous savez que la pression totale à l'intérieur du tube est égale à la pression ambiante du laboratoire, 101,325 kPa. La pression totale comprend les contributions de pression partielle de l'hydrogène gazeux et de vapeur d'eau. Mettre en place une équation en utilisant la loi de Dalton, réorganiser l'équation à résoudre pour la pression de tout le gaz d'hydrogène, branchez vos numéros, et de résoudre:
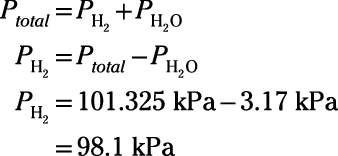
Ainsi, la pression partielle d'hydrogène gazeux piégé dans le tube est 98,1 kPa.





