Comment élever et calculer les points d'ébullition de solvants
Point d'ébullition élévation fait référence à la tendance de la température d'ébullition du solvant à augmenter quand une impureté (soluté) est ajouté. En fait, plus que le soluté est ajoutée, plus la variation de la température d'ébullition.
Le point d'ébullition des élévations ponctuelles sont directement proportionnelles à la molalité d'une solution, mais les chimistes ont découvert que certains solvants sont plus sensibles à cette modification que d'autres. La formule pour le changement dans le point d'une solution d'ébullition, donc, contient une constante de proportionnalité, abrégé Kb, qui est une propriété déterminée expérimentalement et doit être lu à partir d'un tableau comme celui-ci.
| Solvant | Kb en degrés C /m | Point d'ébullition en degrés C |
|---|---|---|
| Acide acétique | 3.07 | 118.1 |
| Benzène | 2.53 | 80,1 |
| Camphre | 5.95 | 204,0 |
| Le tétrachlorure de carbone | 4,95 | 76,7 |
| Cyclohexane | 2.79 | 80,7 |
| Éthanol | 1.19 | 78,4 |
| Phénol | 3.56 | 181,7 |
| Eau | 0,512 | 100,0 |
La formule pour l'élévation du point d'ébullition est
où m est molalité. Notez l'utilisation de la lettre grecque delta dans la formule pour indiquer que vous êtes le calcul d'une changer le point d'ébullition, pas le point d'ébullition lui-même. Vous devez ajouter ce nombre à la pointe du solvant pur d'ébullition pour obtenir le point de la solution d'ébullition. Les unités de Kb sont généralement donnée en degrés Celsius par molalité.
Point d'ébullition élévations sont le résultat de l'attraction entre les particules de solvant et de soluté dans une solution. Les propriétés colligatives telles que le point d'ébullition élévation dépendent uniquement sur le nombre de particules en solution. Ajout de particules de soluté augmente ces attractions intermoléculaires parce que plus les particules sont autour d'attirer un autre. Pour faire bouillir, particules de solvants doivent donc parvenir à une plus grande énergie cinétique pour surmonter cette force d'attraction supplémentaire, ce qui se traduit par un point d'ébullition supérieur.
Essayez cet exemple: Quel est le point d'une solution contenant 45,2 g de menthol d'ébullition (C10H20O) dissous dans 350 g d'acide acétique?
Le problème demande pour le point de la solution d'ébullition, de sorte que vous savez que vous devez d'abord calculer l'élévation du point d'ébullition. Cela signifie que vous devez connaître la molalité de la solution et de la Kb La valeur du solvant (acide acétique). Le tableau vous indique que le Kb d'acide acétique est de 3,07 ° C /m. Pour calculer la molalité, vous devez convertir 45,2 g de menthol aux moles:

Vous pouvez maintenant calculer la molalité de la solution, en prenant soin de convertir les grammes d'acide acétique en kilogrammes:
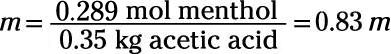
Maintenant que vous avez molalité, vous pouvez le brancher et votre Kb valeur dans la formule pour trouver le changement de point d'ébullition:
Vous n'êtes pas tout à fait terminé, parce que le problème demande pour le point de la solution, pas le changement dans le point d'ébullition ébullition. Heureusement, la dernière étape est tout simple arithmétique. Vous devez ajouter votre
au point d'acide acétique pur, qui, selon le tableau, est de 118,1 degrés Celsius ébullition. Cela vous donne un point final d'ébullition
pour la solution.






