Comment mesurer la concentration en utilisant une solution de molarité et pour cent
Deux moyens importants pour mesurer la concentration sont molarité et solution pour cent. Différents solutés se dissolvent à des degrés différents dans différents solvants dans des conditions différentes. Pour garder une trace de toutes ces différences, les chimistes mesurer la concentration. Qualitativement, une solution avec une grande quantité de soluté est dit être concentré. Une solution avec seulement une petite quantité de soluté est dit être diluer. Quantitativement, nous utilisons Numéros donc, et une solution de molarité pour cent.
Molarité concerne la quantité de soluté au volume de la solution:
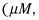
Pour calculer la molarité, vous pourriez avoir à utiliser des facteurs de conversion pour se déplacer entre les unités. Par exemple, si vous êtes donné la masse d'un soluté en grammes, utiliser la masse molaire (généralement arrondi à deux décimales) de ce soluté pour convertir la masse donnée en moles. Si vous êtes donné le volume de solution en millilitres ou une autre unité, vous devez convertir ce volume en litres. Les unités sont la première chose à vérifier si vous obtenez un mal de problème lors de l'utilisation molarité. Assurez-vous que vos unités sont corrects!
Les unités de molarité sont toujours moles par litre (mol / L ou mol # 183-L-1). Ces unités sont souvent abrégés comme M et dénommé "molaire." Ainsi, 0,25 M KOH (aq) Est décrit comme «Point deux-cinq hydroxyde de potassium molaire," et il contient 0,25 mole de KOH par litre de solution. Notez que cela ne pas signifient qu'il y a de KOH 0,25 mole par litre de solvant (l'eau, dans ce cas) - que le volume final de la solution (soluté plus solvant) est important en molarité.
Comme les autres unités, l'unité de molarité peut être modifié par des préfixes standard, comme dans millimolaire (mM, qui est égal à 10-3 mol / L) et micromolaire
qui est égal à 10-6 mol / L).
Solution de pourcentage est une autre façon d'exprimer la concentration commune. Les unités précises de solution pour cent dépendent typiquement de la phase de chaque composant. Pour les solides dissous dans les liquides, pour cent de la masse est généralement utilisé:
Parfois, le terme de solution pour cent est utilisé pour décrire la concentration en fonction du volume final de solution au lieu de la masse finale. Par example:
"5% de Mg (OH)2»Peut signifier 5 g d'hydroxyde de magnésium dans 100 ml de volume final. Ceci est une solution pour cent de la masse-volume.
"% H 22O2»Peut signifier 2 ml de peroxyde d'hydrogène dans 100 ml de volume final. Ceci est une solution pour cent de volume volume.
De toute évidence, en accordant une attention aux unités est important lorsque l'on travaille avec la concentration. Seulement en observant quelles unités sont attachés à une mesure pouvez-vous déterminer si vous travaillez avec molarité, avec pour cent de masse, ou avec une masse-masse, masse volumique, ou une solution pour cent du volume-volume.
Ici'un exemple: Calculer la molarité de la solution et la masse pour cent de volume obtenue en dissolvant 102,9 g de H3PO4 dans 642 ml de volume final de la solution. Assurez-vous d'utiliser les unités appropriées. (Astuce: 642 mL = 0,642 L)
Premièrement, calculez la molarité. Avant de pouvoir utiliser la formule de molarité, cependant, vous devez convertir les grammes de H3PO4 de moles:
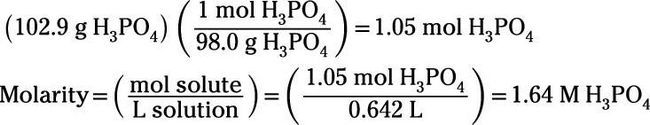
Ensuite, calculer la solution pour cent de masse-volume:
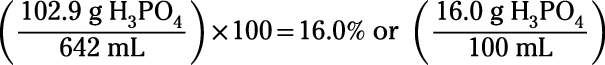
Notez que la convention en molarité est de diviser par taupes litres, mais la convention en pour cent de masse est de diviser grammes par millilitres. Si vous préférez de penser seulement en termes de litres (non millilitres), puis simplement envisager pour cent de masse comme kilogrammes divisé par litres.






