Comment utiliser des formules empiriques pour trouver des formules moléculaires
De nombreux composés dans la nature sont composées d'atomes qui se produisent dans les nombres multiples de leur formule empirique. En d'autres termes, leurs formules empiriques ne reflètent pas le nombre réel d'atomes au sein eux-place, ils ne reflètent que les rapports de ces atomes. Quel ennui!
Heureusement, ceci est une vieille nuisance, alors chimistes ont mis au point un moyen de traiter avec elle. Pour tenir compte de ces types de composés ennuyeux, chimistes font attention à la différence entre une formule empirique et une formule moléculaire. UN formule moléculaire utilise les indices qui rendent compte du nombre réel de chaque type d'atome dans une molécule du composé (a unité de formule accomplit la même chose pour les composés ioniques).
Formules moléculaires sont des masses moléculaires associés à Gram qui sont simples multiples de nombre entier correspondant de la masse formule empirique. Par exemple, une molécule ayant la formule empirique CH2O a une masse formule empirique d'environ 30 g / mol (pour le carbone 12 + 2 pour les deux hydrogènes + 16 pour l'oxygène). La molécule peut avoir une formule moléculaire de CH2O, C2H4O2, C3H6O3, ou analogue. En conséquence, le composé peut avoir une masse moléculaire en grammes de 30 g / mol, 60 g / mol, 90 g / mol, ou un autre multiple de 30 g / mol.
Vous ne pouvez pas calculer une formule moléculaire basée sur la composition de pour cent seulement. Si vous tentez de le faire, Avogadro et Perrin passeront de leurs tombes, vous trouverez, et vous gifler 6,02 x 1023 fois par la joue. Vous pouvez voir clairement la folie d'une telle approche en comparant formaldéhyde avec du glucose. Les deux composés ont la même formule brute, CH2O, mais les formules moléculaires différentes, CH2O et C6H12O6, respectivement.
Le glucose est un sucre simple, celle faite par la photosynthèse et d'une panne lors de la respiration cellulaire. Vous pouvez dissoudre dans votre café avec des résultats agréables. Le formaldéhyde est un composant cancérigène du smog. Solutions de formaldéhyde ont été historiquement utilisé pour embaumer les cadavres. Dissolution de formaldéhyde dans votre café est déconseillé. En d'autres mots, les formules moléculaires diffèrent des formules empiriques, et la différence est importante dans le monde réel.
Pour déterminer une formule moléculaire, vous devez connaître la masse de la formule de gramme du composé ainsi que la formule empirique (ou suffisamment d'informations pour calculer vous-même de la composition de pour cent). Avec ces outils en main, le calcul de la formule moléculaire comporte trois étapes:
Calculer la masse de formule empirique.
Diviser la masse moléculaire, en grammes par la masse de formule empirique.
Multipliez chacun des indices dans la formule empirique par le nombre calculé à l'étape 2.
Ici'un exemple: Quelle est la formule moléculaire d'un composé qui a une masse moléculaire en grammes de 34 g / mol et la formule empirique HO?
Calculer la masse de formule empirique.
Vous déterminez ce nombre par trouver la masse de HO (1 atome d'hydrogène et 1 atome d'oxygène).
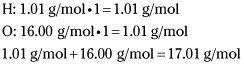
Donc, la masse de formule empirique est 17,01 g / mol.
Diviser la masse moléculaire, en grammes par la masse de formule empirique.
Divisant la masse moléculaire, en grammes par cette valeur donne le résultat suivant:
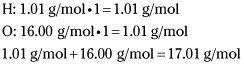
Multipliez chacun des indices dans la formule empirique par le nombre calculé à l'étape 2.
Multipliant les indices dans la formule empirique par ce nombre vous donne la formule moléculaire H2O2. Cette formule correspond au composé peroxyde d'hydrogène.




