Comment travailler avec molalité et fractions molaires
Comme la différence de leurs noms, la différence pratique entre molarité et molalité est subtile. Jetez un oeil à portée de leurs définitions, exprimées côté de l'autre dans les équations suivantes:
Les numérateurs en molarité et Molalité calculs sont identiques, mais leurs dénominateurs diffèrent grandement. Molarité traite de litres de solution, tandis que Molalité offres avec kilogrammes de solvant. UN solution est un mélange de solvant et de soluté d'un solvant est le milieu dans lequel le soluté est mélangé.
Une complication supplémentaire à la confusion molarité / de molalité est de savoir comment faire la distinction entre leurs variables et unités. Pour clarifier cette pléthore de m-mots et leurs abréviations, consultez le tableau.
| Nom | Variable | Unité Abréviation |
|---|---|---|
| Molarité | M | M |
| Molalité | m | m |
| Moles | -- | mol |
Parfois, vous pouvez être invité à calculer la fraction molaire d'une solution, qui est le rapport du nombre de moles de non plus solvant ou soluté dans une solution au nombre total de moles de soluté et solvant dans la solution. Les chimistes définis cette quantité en utilisant la variable X. Bien sûr, les chimistes ont encore besoin de faire la distinction entre les fractions molaires du soluté et le solvant, qui, malheureusement, les deux commencent par la lettre s.
Pour éviter la confusion, ils ont décidé d'abréger soluté et de solvant A et B, respectivement, dans la formule générale. Dans la pratique, les formules chimiques du soluté et le solvant sont habituellement écrites comme des indices à la place de A et B. Par exemple, la fraction molaire de chlorure de sodium dans une solution serait écrit comme XNaCl.
En général, le rapport molaire du soluté dans une solution est exprimée en
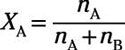
Où nUN est le nombre de moles de soluté et nB est le nombre de moles de solvant. Le rapport molaire du solvant est alors
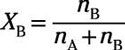
Ces fractions molaires sont utiles car ils représentent le rapport de soluté à la solution et solvant pour solution très bien et vous donner une compréhension générale de la façon dont une grande partie de votre solution est soluté et combien est solvable.
Ici'un exemple: Combien de grammes de sulfure de dihydrogène (H2S) doit vous ajouter à 750 g d'eau pour faire 0,35 m solution?
Ce problème vous donne molalité et la masse d'un solvant et vous demande de résoudre pour la masse de soluté. Parce molalité implique taupes et non grammes de soluté, vous devez d'abord résoudre pour moles de solvant, puis vous utilisez la masse de la formule de grammes de chlorure de sodium à résoudre pour le nombre de grammes de soluté.
Avant de brancher les nombres dans l'équation de molalité, vous devez également noter que le problème vous a donné la masse du solvant en grammes, mais la formule des appels pour qu'il soit en kilogrammes. Déplacement de quelques grammes à kilogramme équivaut à déplacer la virgule décimale de trois à gauche. Brancher tout ce que vous savez dans l'équation pour molalité vous donne ce qui suit:
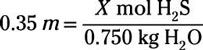
Résoudre pour l'inconnu vous donne 0,26 mole de H2S en solution. Vous devez ensuite multiplier cette valeur par mole de la masse moléculaire de H2S pour déterminer le nombre de grammes qui doivent être ajoutées:
Donc, vous avez besoin 8.9 grammes de sulfure de dihydrogène (H2S) faire un 0,35 m solution.






