Ions: atomes avec une charge électrique
(Atomes ou groupes d'atomes) dans lequel il ya un nombre inégal de protons et d'électrons sont appelés ions
. Habituellement, le nombre de protons et d'électrons dans les atomes sont égaux. Mais il ya des cas dans lesquels un atome peut acquérir une charge électrique.Un exemple d'ions
Par exemple, dans le chlorure de sodium composé - le sel de table - l'atome de sodium a une charge positive et l'atome de chlore a une charge négative.
L'atome de sodium neutre a 11 protons et 11 électrons, ce qui signifie qu'il a 11 charges positives et des charges négatives 11. Dans l'ensemble, l'atome de sodium est neutre, et il est représenté comme ceci: Na. Mais l'ion sodium contient un responsable plus positive que la charge négative, il est donc représentée comme ceci:
Cette inégalité du nombre de charges négatives et positives peut se produire dans l'une des deux manières: Un atome peut gagner un proton (une charge positive) ou perdre un électron (une charge négative).
Cations et anions
Alors, qui le processus est plus susceptible de se produire? En général, il est facile de gagner ou perdre des électrons mais très difficile à gagner ou à perdre des protons. Donc atomes deviennent des ions de gagner ou de perdre des électrons. Et ions qui ont une charge positive sont appelés cations.
La progression va comme ceci: L'ion de sodium ci-dessus est formé à partir de la perte d'un électron. Parce qu'il a perdu un électron, il a plus de protons que d'électrons, ou des taxes plus positifs que les charges négatives, ce qui signifie qu'il est maintenant appelé:
De même, lorsque l'atome de magnésium neutre perd deux électrons, il forme le:
Considérons maintenant l'atome de chlore dans le chlorure de sodium. L'atome de chlore neutre a acquis une charge négative en gagnant un électron. Parce qu'il a un nombre inégal de protons et d'électrons, il est maintenant un ion. Et parce que les ions qui ont une charge négative sont appelés anions, il est maintenant appelé:
Autres détails sur ions
Voici quelques bribes supplémentaires environ ions:
Vous pouvez écrire configurations électroniques et des diagrammes de niveau d'énergie des ions. L'atome de sodium neutre (11 protons) présente une configuration d'électrons consistant à:
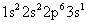
Le cation de sodium a perdu un électron - l'électron de valence, qui est la plus éloignée du noyau (l'électron 3s, dans ce cas). La configuration électronique de l'ion sodium est la suivante:
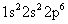
La configuration électronique de l'ion chlorure est le suivant:
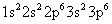
Ceci est la configuration d'électrons en tant que le même atome d'argon neutre. Si deux espèces chimiques ont configuration électronique même, ils sont dit être isoélectronique.
Les exemples précédents sont tous (un atome) ions monoatomiques. Mais un grand nombre (Atom) ions polyatomiques existent. L'ion ammonium est un ion polyatomique, ou, plus précisément, un cation polyatomique. Il est écrit que:
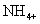
L'ion nitrate, est également un ion polyatomique, ou, plus précisément, un anion polyatomique. Il est écrit que
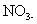
Ions sont généralement trouvés dans une classe de composés appelés sels, ou des solides ioniques. Sels, lorsqu'il est fondu ou dissous dans l'eau, des solutions de rendement qui conduisent l'électricité.
Une substance qui conduit l'électricité lorsqu'il est fondu ou dissous dans l'eau est appelé électrolyte. Le sel de table - de chlorure de sodium - est un bon exemple.
D'autre part, lorsque le sucre de table (saccharose) est dissous dans de l'eau, elle devient une solution qui ne conduit pas l'électricité. Donc, le saccharose est un non électrolyte.
Si une substance est un électrolyte ou un non électrolyte donne des indices sur le type de liaison dans le composé. Si la substance est un électrolyte, le composé est probablement lié ioniquement. Si elle est un non électrolyte, il est probablement lié de façon covalente.




