Obligations multiples dans la liaison covalente
Ccollage ovalent est le partage d'une ou plusieurs paires d'électrons. Dans de nombreuses situations de liaison covalentes, de multiples liaisons chimiques existent - plus d'une paire d'électrons est partagée. (Dans hydrogène et les autres molécules diatomiques, une seule paire d'électrons est partagé.)
L'azote est une molécule diatomique dans la Famille VA sur la table périodique. Azote a cinq électrons de valence, donc il a besoin plus de trois électrons de valence pour compléter son octet.
Un atome d'azote peut remplir son octet en partageant trois électrons avec un autre atome d'azote, formant trois liaisons covalentes, un soi-disant triple liaison. La formation de triple liaison d'azote est montré dans la figure suivante.
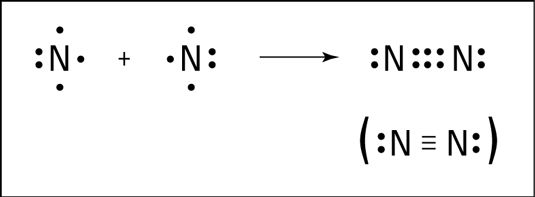
Un triple liaison est pas tout à fait trois fois plus forte que une liaison simple, mais il est un lien très fort. En fait, la triple liaison dans de l'azote est l'un des liens les plus forts connus. Ce lien fort est ce qui rend l'azote très stable et résistant à la réaction avec d'autres produits chimiques.
Il est également la raison pour laquelle de nombreux composés explosifs (tels que le TNT et le nitrate d'ammonium) contiennent de l'azote. Lorsque ces composés se séparent dans une réaction chimique, de l'azote gazeux est formé, et une grande quantité d'énergie est libérée.
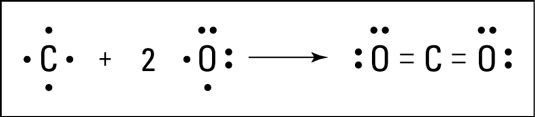
Le dioxyde de carbone est un autre exemple d'un composé contenant une liaison multiple. Le carbone peut réagir avec l'oxygène pour former du dioxyde de carbone. Carbone a quatre électrons de valence, et de l'oxygène en a six. Le carbone peut partager deux de ses électrons de valence avec chacun des deux atomes d'oxygène, formant deux doubles liaisons. Ces doubles liaisons sont présentés dans la figure suivante.