Règles pour l'attribution de numéros d'oxydation à des éléments
Les nombres d'oxydation sont des nombres de tenue de livres. Ils permettent aux chimistes de faire des choses telles que l'équilibre redox (rougeuction /bœufidation) équations. Les nombres d'oxydation sont des nombres positifs ou négatifs, mais ne les confondent pas avec les charges positives ou négatives sur les ions ou valences.
Les nombres d'oxydation sont attribués à des éléments à l'aide de ces règles:
Règle 1: Le nombre d'oxydation d'un élément dans son (non combiné) état libre est zéro - par exemple, Al (s) ou Zn (s). Cela est également vrai pour les éléments trouvés dans la nature comme diatomique (deux éléments atomiques)
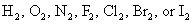
et pour le soufre, a trouvé que:
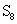
Règle 2: Le nombre d'oxydation d'un monoatomique (un atome) ion est la même que la charge de l'ion, par exemple:
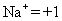
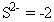
Règle 3: La somme de tous les nombres d'oxydation en un composé neutre est nul. La somme de tous les nombres d'oxydation dans un polyatomique (plusieurs atome) ion est égale à la charge de l'ion. Cette règle permet souvent chimistes pour calculer le nombre d'oxydation d'un atome qui peut avoir plusieurs états d'oxydation, si les autres atomes dans l'ion ont connu nombres d'oxydation.
Règle 4: Le nombre d'oxydation d'un métal alcalin (famille IA) en un composé est le 1- + nombre d'oxydation d'un métal alcalino-terreux (de la famille IIA) est un composé à deux.
Règle 5: Le nombre d'oxydation de l'oxygène dans un composé est habituellement -2. Si, par contre, l'oxygène est dans une classe de composés appelés peroxydes (par exemple, le peroxyde d'hydrogène), alors l'oxygène a un nombre d'oxydation de -1. Si l'oxygène est lié à un atome de fluor, le nombre est 1.
Règle 6: L'état d'oxydation de l'hydrogène dans un composé est habituellement 1. Si l'hydrogène est partie d'un binaire hydrure de métal (composé de l'hydrogène et un peu de métal), alors l'état d'oxydation de l'hydrogène est -1.
Règle 7: Le nombre d'oxydation d'un atome de fluor est toujours -1. Le chlore, le brome et l'iode ont généralement un nombre d'oxydation de -1, sauf si elles sont en association avec un atome d'oxygène ou un atome de fluor.
Ces règles vous donnent une autre façon de définir oxydation et de réduction - en termes de nombres d'oxydation. Par exemple, considérons cette réaction, ce qui montre l'oxydation par la perte d'électrons:
Notez que le métal de zinc (le réactif) a un nombre d'oxydation de zéro (règle 1), et le cation de zinc (le produit) a un nombre d'oxydation de +2 (règle 2). En général, vous pouvez dire qu'une substance est oxydé quand il ya une augmentation de son nombre d'oxydation.
Réduction fonctionne de la même façon. Considérez cette réaction:
Le cuivre va d'un nombre d'oxydation de 2 à zéro. Une substance est réduite si il ya une diminution de son nombre d'oxydation.






