En voyant comment l'osmose affecte la chimie du sang
La pression osmotique est un principe chimique de base, mais il joue également un rôle dans la biologie. En fait, l'osmose qui se passe dans votre corps dès maintenant que vos systèmes biologiques travaillent à maintenir l'équilibre dans la chimie de votre sang.
Supposons que vous prenez un récipient et de le diviser en deux compartiments en utilisant une fine membrane qui contient pores- microscopique les pores sont suffisamment grands pour permettre des molécules d'eau à passer à travers, mais pas de particules de soluté. Ce type de membrane est appelée semjeaux membranes perméables il permet seulement quelques petites particules traversent.
Vous puis ajouter une solution de sel concentrée à un compartiment et une solution de sel diluée plus à l'autre. Initialement, les volumes des deux solutions de départ est le même. Mais après un moment, vous remarquez que le niveau sur le côté plus concentré a augmenté et que le niveau sur le côté plus dilué a chuté. Ce changement de niveau est dû au passage de molécules d'eau à partir du côté plus diluée au côté le plus concentré à travers la membrane semi-perméable. Ce processus est appelé osmose, le passage d'un solvant à travers une membrane semi-perméable dans une solution de concentration de soluté ultérieure. La pression que vous auriez à exercer sur le côté plus concentrée afin d'arrêter ce processus est appelé pression osmotique.
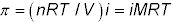
Le solvant coule toujours à travers la membrane semi-perméable du côté plus diluée au côté le plus concentré. En fait, vous pouvez avoir de l'eau pure d'un côté et toute solution de sel sur l'autre, et l'eau va toujours du côté de l'eau pure sur le côté sel solution. Le plus concentré la solution de sel, plus la pression qu'il faut pour arrêter l'osmose (plus la pression osmotique).
Mais que faire si vous appliquez plus de pression que nécessaire pour arrêter le processus osmotique, supérieure à la pression osmotique? L'eau est forcée à travers la membrane semi-perméable depuis le côté plus concentré sur le côté plus diluée dans un processus appelé inverser osmosis. L'osmose inverse est un bon moyen, relativement peu coûteux de purifier l'eau. Le monde a beaucoup de plantes d'osmose inverse qui extraient l'eau potable à partir d'eau de mer. Pilotes de la Marine portent même de petites unités d'osmose inverse avec eux au cas où ils ont pour éjecter en mer.
Les parois cellulaires agissent souvent comme des membranes semi-perméables. Avez-vous jamais manger des cornichons? Concombres sont trempés dans une solution de saumure afin de faire des cornichons. La concentration de la solution à l'intérieur du concombre est inférieure à la concentration de la solution de saumure, afin que l'eau migre à travers les parois des cellules dans la saumure, provoquant la rétraction de concombre.
Une des conséquences les plus biologiquement importante de la pression osmotique implique les cellules au sein de votre propre corps. Par exemple, dans un globule rouge est une solution aqueuse, et en dehors de la cellule est une autre solution aqueuse (liquide intercellulaire). Lorsque la solution hors de la cellule a la même pression osmotique que la solution à l'intérieur de la cellule, qui est en dehors de ladite solution soit isotonique.
L'eau peut être échangé dans les deux sens, en aidant à maintenir la cellule saine. Toutefois, si le fluide intercellulaire devient plus concentré et a une pression osmotique plus élevée (la solution est hypertonique), L'eau circule principalement sur la cellule de sang, l'amenant à se rétrécir et de forme irrégulière. Ce processus, appelé crénelure, peut se produire si la personne devient gravement déshydraté.
Les cellules crénelées ne sont pas aussi efficaces dans la réalisation de l'oxygène. Si, d'autre part, le fluide intercellulaire est plus diluée que la solution à l'intérieur des cellules et présente une pression osmotique inférieure (la solution est hypotonique), Le flux d'eau pour la plupart dans la cellule. Ce processus, appelé hemolySIS, provoque la cellule à gonfler et éventuellement rompre.
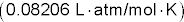
Les processus de crénelure et hémolyse expliquent pourquoi la concentration des solutions IV est si critique. Si elles sont trop dilués, puis hémolyse peut avoir lieu, et si elles sont trop concentré, crénelure est une possibilité.
Vous pouvez calculer la pression osmotique (N ° 960-) en utilisant l'équation suivante:
Dans cette équation, 960- # est la pression osmotique en atmosphères, n est le nombre de moles de soluté, R est la constante des gaz parfaits, T est la température Kelvin, V est le volume de la solution en litres, et je est le facteur van't Hoff (le nombre de moles de particules qui sera formée à partir d'une mole de soluté) - n/V peut être remplacé par M, la molarité de la solution.






