Garder un système à température constante: le processus isotherme
En physique, lorsque la température reste constante que d'autres quantités changement, vous avez ce qu'on appelle un système isotherme. Appareil remarquable dans la première figure montre un exemple d'un système isotherme.
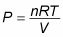
Il est spécialement conçu pour maintenir la température de la constante de gaz enfermé, alors même que le piston monte. Lorsque vous appliquer de la chaleur à ce système, le piston se lève ou abaisse lentement de manière à maintenir constant le produit de fois le volume de pression. Car PV = nRT, la température reste constante ainsi. (Rappelez-vous que n est le nombre de moles de gaz qui reste constante, et R est la constante des gaz).
Qu'est-ce que le travail ressemble que les changements de volume? Car PV = nRT, la relation entre P et V est
Vous pouvez voir cette équation graphiquement dans la deuxième figure, qui montre le travail accompli que la zone ombrée sous la courbe. Mais ce que le diable est ce domaine?

Le travail effectué dans un processus isotherme est donnée par l'équation suivante, où ln est le logarithme naturel (ln sur votre calculatrice), R est la constante des gaz # 8232;
VF est le volume final, et Vje est le volume initial:
Étant donné que la température reste constante dans un procédé isotherme et parce que l'énergie interne pour un gaz parfait est égal à (3/2)nRT, l'énergie interne ne change pas. Par conséquent, vous trouverez que la chaleur est égal au travail effectué par le système:
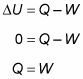
Si vous immerger la bouteille que vous voyez dans la première figure dans un bain de chaleur, ce qui se passerait? La chaleur, Q, coulerait dans l'appareil, et parce que la température du gaz reste constante, toute cette chaleur deviendrait travail effectué par le système.
Dire que vous avez un grain d'hélium à jouer avec un jour de pluie de la température de 20 degrés Celsius, et pour le plaisir de vous décider à le développer à partir de Vje = 0,010 m3 à # 8232-VF = 0,020 m3. Quel est le travail effectué par le gaz dans l'extension? Tout ce que vous avez à faire est de brancher les numéros:

Le gaz fait 1.690 joules de travail. Le changement de gaz dans l'énergie interne est 0 joules, comme toujours dans un processus isotherme. Et parce que Q = W, la chaleur ajoutée au gaz est aussi égal à 1,690 joules.
Voici un autre exemple. Dites que vous êtes donné 2,0 moles de gaz d'hydrogène à une température de 600 kelvins pour votre anniversaire. Élargir le gaz d'un volume de 0,05 mètres cubes à 0.10 mètres isotherme, vous vous demandez combien de travail du gaz, ainsi vous obtenez sur votre presse-papiers. Le travail effectué par un gaz parfait lors de l'expansion isotherme est
Brancher les chiffres et faire le calcul vous donne

Donc, le gaz ne 6.900 joules de travail lors de son expansion.
Alors que dire de la variation de l'énergie interne du gaz? Vous savez que la variation de l'énergie interne est

la détente isotherme.






