Les cellules électrochimiques: cellules de lampe de poche
La cellule de lampe de poche commun, une cellule électrochimique à sec, est contenue dans un boîtier de zinc qui agit comme l'anode (l'électrode à laquelle l'oxydation a lieu). L'autre électrode, la cathode (où la réduction a lieu), est une tige de graphite dans le milieu de la cellule.
Une couche d'oxyde de manganèse et de noir de carbone (l'une des nombreuses formes de carbone) entoure la tige de graphite, et une pâte épaisse de chlorure d'ammonium et le chlorure de zinc sert d'électrolyte. Le diagramme montre la structure d'une cellule sèche. Les réactions de piles sèches sont présentés dans ce qui suit.
Anode réaction / oxydation:
Cathode réaction / réduction:
Notez que le cas de la pile sèche est en fait l'un des electrodes- il est utilisé dans la réaction. Si il ya une tache mince dans le cas, un trou pourrait former, et la cellule pourrait fuir le contenu corrosifs. En outre, le chlorure d'ammonium a tendance à corroder le boîtier métallique, de nouveau en permettant à la possibilité de fuite.
Dans la cellule sèche alcaline (pile alcaline), le chlorure d'ammonium acide de la pile sèche ordinaire est remplacé par de base (alcalin) d'hydroxyde de potassium. Avec ce produit chimique, à la corrosion du boîtier de zinc est fortement réduite.
Une batterie est composée de deux ou plusieurs cellules connectées ensemble. Vous mettez une batterie dans votre voiture, mais vous mettez une cellule dans votre lampe de poche.
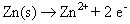
Une autre cellule de la même construction de base est la petite pile au mercure couramment utilisé dans les montres, les stimulateurs cardiaques, et ainsi de suite. Avec cette batterie, l'anode est du zinc, comme dans la pile sèche ordinaire, mais la cathode est en acier. Le mercure (II) oxyde (HgO) et de la pâte alcaline former l'électrolyte.
Vous devez disposer de petites piles au mercure (tels que ceux utilisés dans les montres) attentivement, pour garder le mercure d'être libérés dans l'environnement.
Toutes ces cellules galvaniques produisent de l'électricité jusqu'à ce qu'ils manquent d'un réactif. Ensuite, ils doivent être jetés. Cependant, il existe des cellules qui peuvent être rechargées, comme la réaction d'oxydo-réduction peut être inversé pour régénérer les réactifs d'origine. Nickel-cadmium (Ni-Cad) et les batteries au lithium entrent dans cette catégorie. Le type le plus familier de la batterie rechargeable est probablement la batterie d'automobile.



