Les cellules électrochimiques: batteries automobiles
La batterie de l'automobile, ou accumulateur au plomb, se compose de six cellules électrochimiques connectées en série. L'anode de chaque cellule est le plomb, tandis que la cathode est du dioxyde de plomb.
Dioxyde de plomb est représentée comme suit:
Les électrodes sont immergées dans une solution d'acide sulfurique. L'acide sulfurique est représentée comme suit:
Lorsque vous démarrez votre voiture, les réactions cellulaires suivantes ont lieu:
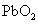
Lorsque cette réaction a lieu, les deux électrodes se recouvrir de plomb solide sulfate (II), et de l'acide sulfurique est utilisé en place.
Après l'automobile a été lancé, l'alternateur ou générateur prend en charge le travail de production d'électricité (pour les bougies, lampes, etc.) et se recharge également la batterie. L'alternateur inverse à la fois le flux d'électrons dans la batterie et les réactions d'oxydo-réduction d'origine, et régénère le plomb et le dioxyde de plomb:
L'accumulateur au plomb peut être chargé et déchargé plusieurs fois. Mais le choc de courir sur les bosses de la route ou dans les flocons de trottoir off un peu de plomb (II) sulfate et provoque finalement la batterie à l'échec.
Pendant la charge, la batterie de l'automobile agit comme un second type de cellule électrochimique, un Cellule électrolytique, qui utilise l'électricité pour produire une réaction d'oxydo-réduction souhaitée.




