Les liaisons ioniques: pourquoi et comment les ions sont formés
Liaison ionique est le type de liaison qui détient sels ensemble. Pour mieux comprendre pourquoi et comment ions
Sommaire
Le composants: sodium et le chlore
Le processus de création de sel de table est assez remarquable. Vous prenez deux substances qui sont à la fois très dangereux, et d'eux que vous faites une substance qui est nécessaire à la vie:
Sodium est un métal alcalin, un membre de la famille IA de la classification périodique des éléments. Les chiffres romains en haut des familles un spectacle le nombre d'électrons de valence (s et p électrons dans le niveau d'énergie plus à l'extérieur) dans l'élément particulier. Donc sodium a une valence électronique et 11 électrons totaux parce que son numéro atomique est 11.
Chlore est un membre de la famille des halogènes - la famille VIIA de la classification périodique des éléments. Il dispose de 7 électrons de valence et un total de 17 électrons.
Vous pouvez utiliser un diagramme de niveau d'énergie pour représenter la distribution des électrons dans un atome. Le schéma de niveau d'énergie pour le sodium et le chlore est montré dans la figure suivante.
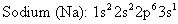
Au lieu d'utiliser le schéma des niveaux d'énergie pour représenter la distribution des électrons dans un atome, on peut utiliser la configuration d'électrons. Ecrire, dans l'ordre, les niveaux d'énergie utilisés, les types orbitaux (S, P, D, et ainsi de suite), et - en exposant - le nombre d'électrons dans chaque orbitale.
Voici les configurations électroniques pour le sodium et le chlore:
La réaction chimique
Les gaz rares sont les éléments VIIIA du tableau périodique. Ils sont non réactif parce que leur niveau d'énergie de valence (de niveau d'énergie à l'extérieur) est rempli. Parvenir à un (complet) le niveau d'énergie de valence remplie est une force motrice dans la nature en termes de réactions chimiques, parce que ce lorsque les éléments deviennent stables. Ils ne perdent pas, le gain, ou partagent des électrons.
Les autres éléments dans les familles A sur le tableau périodique ne gagnez, perdre ou partager les électrons de valence pour remplir leur niveau d'énergie de valence et de devenir stable.
Parce que ce processus, dans la plupart des cas, consiste à remplir les s ultrapériphériques et orbitales p, il est parfois appelé le règle de l'octet - éléments gain, perdre, ou de partager des électrons pour atteindre une pleine octet (8 électrons de valence: 2 dans le orbitale s et 6 dans le orbitale p).
Le rôle de sodium
Sodium a un électrons de valence par la règle de l'octet, il devient stable quand il a huit électrons de valence. Deux possibilités existent pour le sodium se stabilise:
Il peut gagner sept plus d'électrons pour remplir le niveau d'énergie 3.
Il peut perdre l'électron 3s un, afin que le niveau d'énergie 2 (qui est rempli à huit électrons) devient le niveau d'énergie de valence.
En général, la perte ou le gain d'un, deux, ou parfois même trois électrons peuvent se produire, mais un élément n'a pas perdre ou gagner plus de trois électrons. Donc, pour gagner de la stabilité, de sodium perd son électron 3s.
À ce point, il a 11 protons (11 charges positives) et 10 électrons (10 charges négatives). L'atome de sodium fois neutre a maintenant une seule charge positive [11 plus (+) 10 (-) est égal à 1+]. Il est maintenant un ion. Et ions qui ont une charge positive (tel que le sodium) en raison de la perte d'électrons sont appelés cations.
Vous pouvez écrire une configuration d'électrons pour le cation de sodium:
Le rôle de chlore
Le chlore a sept électrons de valence. Pour obtenir sa pleine octet, il doit perdre les sept électrons du niveau d'énergie 3 ou gagner un à ce niveau. Parce que les éléments ne gagnent ou perdent plus de trois électrons, le chlore doit gagner un seul électron à combler niveau d'énergie 3.
À ce stade, le chlore a 17 protons (17 charges positives) et 18 électrons (18 charges négatives). Donc, le chlore devient un ion avec une seule charge négative. L'atome de chlore neutre devient l'ion chlorure. Ions avec une charge négative en raison du gain d'électrons sont appelés anions.
Le dispositif électronique de l'anion chlorure est le suivant:
De se retrouver avec une liaison
Sodium peut atteindre son plein octet et la stabilité en perdant un électron. Le chlore peut remplir son octet en gagnant un électron. Si les deux sont dans un même récipient, puis le sodium perd des électrons peuvent être les mêmes gains de chlore électrons.
Le transfert d'un électron crée des ions - cations (charges positives) et des anions (charges négatives) - et de charges opposées attirer l'autre. Le cation sodium attire l'anion chlore et forme le composé de NaCl, ou sel de table.
Ceci est un exemple d'un liaison ionique, qui est une liaison chimique (une force d'attraction qui maintient une forte deux éléments chimiques ensemble) qui provient de la attraction électrostatique (attraction de charges opposées) entre cations et anions.
Les composés qui ont des liaisons ioniques sont communément appelés sels. Dans chlorure de sodium, un cristal est formé dans lequel chaque cation sodium est entouré par six anions chlorure différents, et chaque anion chlorure est entouré par six différents cations sodium. La structure cristalline est montré dans la figure suivante. Remarquez la structure régulière répéter.
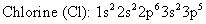
Différents types de sels ont différentes structures cristallines. Cations et anions peuvent avoir plus d'une unité de charge positive ou négative si elles perdent ou gagnent plus d'un électron. Dans ce mode, de nombreux types de sels sont possibles.




