Les liaisons covalentes: un exemple d'hydrogène
UN une liaison covalente
est une liaison chimique qui provient de la mise en commun d'une ou plusieurs paires d'électrons entre deux atomes. L'hydrogène est un exemple d'un composé covalent extrêmement simple.Un exemple d'hydrogène
L'hydrogène est n ° 1 sur le tableau périodique. L'hydrogène dans la nature est souvent constitué d'un atome individuel. Il est principalement trouvé que le diatomique (deux atomes) composé:
L'hydrogène a un électron de valence. Il aimerait gagner un autre électron pour remplir son niveau d'énergie 1s, ce qui en ferait isoélectronique avec de l'hélium (parce que les deux auraient la même configuration électronique), le gaz noble le plus proche.
Le niveau d'énergie 1 ne peut contenir deux électrons dans les orbitales 1s, donc gagner un autre électron remplit. Voilà la force motrice de l'hydrogène - remplissage, le niveau d'énergie de valence et la réalisation de la même disposition d'électrons comme le gaz noble le plus proche.
Imaginer un atome d'hydrogène transférant son seul électron à un autre atome d'hydrogène. L'atome d'hydrogène recevoir l'électron remplit sa couche de valence et la stabilité atteint tout en devenant un anion. Cependant, l'autre atome d'hydrogène a maintenant pas d'électrons et se déplace plus loin de la stabilité.
Ce processus de perte et de gain d'électrons tout simplement ne se fera pas, parce que la force motrice de deux atomes est de remplir leur niveau d'énergie de valence. Donc, le composé d'hydrogène ne peut pas résulter de la perte ou le gain d'électrons. Quoi pouvoir arriver est que les deux atomes peuvent partager leurs électrons. Au niveau atomique, ce partage est représenté par les orbitales d'électrons (parfois appelés nuages d'électrons) de chevauchement.
Les deux électrons (un de chaque atome d'hydrogène) “ appartiennent ” à deux atomes. Chaque atome d'hydrogène se sent l'effet des deux electrons- chacun a, en quelque sorte, son niveau rempli d'énergie de valence. Une liaison covalente est formée. Le chevauchement des orbitales électroniques et le partage d'une paire d'électrons est représenté dans la partie (a) de la figure ci-dessous.
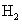
Une autre façon de représenter ce procédé est l'utilisation d'un formule d'électrons-dot. Dans ce type de formule, les électrons de valence sont représentées sous forme de points qui entourent le symbole atomique, et les électrons partagés sont présentés entre les deux atomes impliqués dans la liaison covalente. La formule représentations d'électrons-points sont présentés dans la partie (b) de la figure précédente.
Vous pouvez également utiliser une modification de la formule d'électrons-point appelé Lewis formule structurelle- il est essentiellement la même que la formule d'électrons-point, mais la paire partagée d'électrons (la liaison covalente) est représenté par un tiret. La formule structurelle de Lewis est représenté sur la partie (c) de la figure précédente.
En plus de l'hydrogène, six autres éléments se trouvent dans la nature sous la forme diatomique: l'oxygène, l'azote, le fluor, le chlore, le brome et l'iode.
Comparaison des liaisons covalentes avec d'autres obligations
Se produit une liaison ionique entre un métal et un non-métal. La liaison covalente, d'autre part, se produit entre deux non-métaux. Les propriétés de ces deux types de composés sont différents. Les composés ioniques sont généralement solides à température ambiante, tandis que les composés liés de façon covalente peuvent être solides, liquides ou de gaz.
Les composés ioniques (sels) ont généralement un point de fusion beaucoup plus élevé que des composés covalents. En outre, des composés ioniques ont tendance à être des électrolytes et des composés covalents ont tendance à être non-électrolytes.
Vous pensez peut-être: “ Si métaux réagissent avec les non-métaux pour former des liaisons ioniques, non-métaux et non-métaux réagissent avec d'autres pour former des liaisons covalentes, faire réagir les métaux avec d'autres métaux ”?; La réponse est oui et non.
Les métaux ne réagissent pas vraiment avec d'autres métaux pour former des composés. Au lieu de cela, les métaux se combinent pour former alliages, solutions d'un métal dans un autre. Mais il y a une telle situation comme liaison métallique, et il est présent dans les deux alliages et les métaux purs.
Dans liaison métallique, les électrons de valence de chaque atome de métal sont reversés à une piscine d'électrons, communément appelé mer d'électrons, et sont partagées par tous les atomes dans le métal. Ces électrons de valence sont libres de se déplacer à travers l'échantillon au lieu d'être étroitement lié à un noyau métallique individuel. L'aptitude des électrons de valence de circuler dans tout l'échantillon métallique est la raison pour laquelle les métaux ont tendance à être conducteurs de l'électricité et de la chaleur.




