Garder un système à chaleur constante: le processus adiabatique
En physique, quand vous avez un processus où coule depuis ou vers le système pas de chaleur, il est appelé processus adiabatique. La première figure montre un exemple d'un procédé adiabatique: un cylindre entouré par un matériau isolant. L'isolation empêche la chaleur de se jeter dans ou hors du système, de sorte que tout changement dans le système est adiabatique.
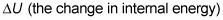
L'examen du travail accompli durant un processus adiabatique, vous pouvez dire Q = 0, de sorte que
égal à égal -W.
Le signe moins est en face de la W parce que l'énergie pour faire le travail vient du système lui-même, ce faisant, les résultats du travail dans une énergie interne inférieure.
Parce que l'énergie interne d'un gaz parfait est U = (3/2)nRT, le travail effectué est le suivant:
où TF représente la température finale et Tje représente la température initiale. Donc, si le gaz ne fonctionne, que le travail vient d'un changement de température - si la température descend, le gaz ne fonctionne sur son environnement.
Vous pouvez voir ce qu'est un graphique de la pression en fonction du volume ressemble à un processus adiabatique dans la deuxième figure. La courbe adiabatique sur cette figure, appelée adiabatique, est différent à partir des courbes isothermes, appelée isothermes. Le travail effectué lors de la chaleur totale dans le système est constante est la zone ombrée sous la courbe.
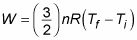
Dans détente adiabatique ou de compression, vous pouvez rapporter la pression initiale et le volume à la pression finale et le volume de cette façon:

pression constante divisée par la capacité thermique spécifique d'un gaz parfait à volume constant (la capacité thermique spécifique est la mesure de la quantité de chaleur d'un objet peut contenir):
Comment pouvez-vous trouver ces capacités thermiques spécifiques? Cela venir jusqu'à la prochaine.
Pour déterminer la capacité thermique spécifique, vous devez relier la chaleur, Q, et la température, T. Vous utilisez généralement la formule

représente le changement de température.
Pour les gaz, cependant, il est plus facile de parler en termes de la capacité thermique spécifique molaire, qui est donnée par C et dont les unités sont joules / mole-kelvin
Avec une capacité de chaleur spécifique molaire, vous utilisez un nombre de moles, n, plutôt que # 8232-la masse, m:
Pour résoudre pour C, vous devez tenir compte de deux quantités différentes, CP (pression constante) et CV (volume constant). Résolu pour Q, la première loi de la thermodynamique affirme que

la variation d'énergie interne d'un gaz parfait, est
Donc, Q à volume constant est la suivante:
Maintenant, regardez la chaleur à pression constante (QP). À pression constante, travail (W) égal à égal

Par conséquent, voici Q à pression constante:
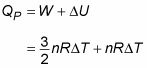
Alors, comment obtenez-vous les capacités thermiques spécifiques molaires de cela? Vous avez décidé que
qui concerne l'échange de chaleur, Q, à la différence de température,
par l'intermédiaire de la capacité thermique massique molaire, C. Cette équation est vrai pour l'échange de chaleur à volume constant, QV, de sorte que vous écrivez
où CV est la capacité de chaleur spécifique à volume constant. Vous avez déjà une expression pour QV, de sorte que vous pouvez remplacer dans l'équation plus tôt:
Ensuite, vous pouvez diviser par deux côtés
pour obtenir la capacité de chaleur spécifique à volume constant:
Si vous répétez cela pour la capacité de chaleur spécifique à pression constante, vous obtenez
Maintenant que vous avez les capacités thermiques spécifiques molaires d'un gaz parfait.
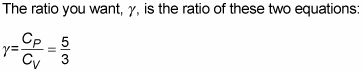
Pour un gaz parfait, vous pouvez vous connecter pression et le volume en deux points quelconques le long d'une courbe adiabatique de cette façon:






