Comment prédire la solubilité sur la base de la température
Augmenter la température amplifie les effets de l'entropie d'un système. Parce que l'entropie d'un soluté est généralement augmentée quand il se dissout, la température augmente la solubilité augmente généralement - pour les solutés liquides et solides, de toute façon. Une autre façon de comprendre l'effet de la température sur la solubilité est de penser à la chaleur comme réactif dans la réaction de dissolution:
La chaleur est généralement absorbée par les particules de soluté dissout quand un soluté. Augmentation de la température correspond à chaleur ajoutée. Ainsi, par augmentation de la température, seront fournies un réactif nécessaire à la réaction de dissolution. (Dans les rares cas où la dissolution libère de la chaleur, la température augmente peut diminuer la solubilité.)
Solutés gazeux se comportent différemment des solutés solides ou liquides en ce qui concerne la température. L'augmentation de la température tend à diminuer la solubilité du gaz dans le liquide. Pour comprendre ce modèle, consultez le concept de la pression de vapeur. L'augmentation de température augmente la pression de vapeur parce que la chaleur ajoutée augmente l'énergie cinétique des particules en solution. Avec l'énergie ajoutée, ces particules représentent plus de chance de se libérer des forces intermoléculaires qui les maintiennent en solution. A, exemple classique de la vie réelle de l'effet de la température sur la solubilité des gaz est carbonate de soude. Qui va plat (perd son gaz dissous de dioxyde de carbone) plus rapidement: la soude chaude ou froide de soude?
En comparant la solubilité des gaz dans les liquides avec le concept de la pression de vapeur met en évidence un autre motif important de: augmentation de la pression augmente la solubilité d'un gaz dans un liquide. Tout comme les hautes pressions font qu'il est plus difficile pour les molécules liquides pour échapper en phase vapeur d'habitation en surface, des pressions élevées empêchent la fuite de gaz dissous dans un solvant. Henri's la loi résume cette relation entre la pression et la solubilité des gaz:
Solubilité = constante x Pression
La "constante" de la loi de Henry est Henri's constante, et sa valeur dépend du gaz, du solvant et de la température. Une forme particulièrement utile de la loi de Henry concerne la solubilité (S) et pression (P) entre deux états différents:
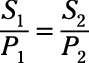
Selon cette relation, triplant la pression triple la solubilité des gaz.
TRy an exemple. La constante de Henry pour le gaz d'azote (N2) Dans de l'eau à 293 K est
La pression partielle de l'azote dans l'air au niveau de la mer est de 0,78 atm. Quelle est la solubilité du N2 dans un verre d'eau à 20 degrés Celsius assis sur une table du café dans une maison de plage?
Ce problème nécessite l'application directe de la loi de Henry. Le verre d'eau est à 20 degrés Celsius, ce qui équivaut à 293 K (il suffit d'ajouter 273 à quelle température en degrés Celsius pour obtenir l'équivalent Kelvin). Parce que le verre se trouve dans une maison sur la plage, vous pouvez supposer que le verre est au niveau de la mer. Ainsi, vous pouvez utiliser les valeurs fournies pour la pression constante et la partielle de Henry de N2:
Ainsi, la solubilité du N2 est






