L'étude de cinétique,
la vitesse des réactions chimiques, est essentiel à l'étude de la chimie et est un thème majeur dans une classe de chimie II. Connaître les notions de cinétique peut aider votre compréhension des raisons pour lesquelles certaines réactions sont rapides et d'autres lentes et pourquoi certaines réactions simples sont lents et d'autres, des réactions plus complexes sont rapides.
La vitesse de réaction (la vitesse de réaction) est la variation de la concentration d'un réactif ou produit par le changement dans le temps. Vous pouvez l'écrire comme:
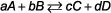
Les chimistes mesurent normalement la concentration en termes de molarité, M, et le temps est généralement exprimé en secondes, s, ce qui signifie que les unités de la vitesse de réaction sont M / s. Vous pouvez exprimer le nombre d'unités à d'autres moyens tels que:
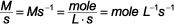
Comment résoudre les problèmes d'équilibre homogène
La constante d'équilibre décrit la relation entre les quantités des réactifs et les produits à une certaine température. Vous aurez besoin de connaître la constante d'équilibre que vous étudiez Chimie II. Pour l'équilibre général:
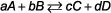
l'expression constante d'équilibre est:
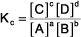
Dans l'expression, K est la constante d'équilibre, l'indice c indique cette constante est exprimée en termes de concentrations (pas de pressions, p), les supports (comme d'habitude) représentent molaire (mole / L) de concentration, les lettres majuscules sont les espèces de réactifs et de produits, et les exposants minuscules sont les coefficients dans l'équation chimique équilibrée.
Résolution équilibre acido-basique Problèmes
La l'acide et de l'équilibre de base constante expressions décrivent la relation entre les quantités de réactifs et des produits dans les systèmes aqueux acide-base. Pour l'équilibre acide faible générale suivante:
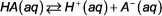
l'expression constante d'équilibre est:
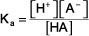
Pour un équilibre général base faible:

l'expression constante d'équilibre est:
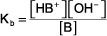
La concentration de l'eau (ou de tout liquide ou solvant pur ou solide) apparaît dans l'expression constante d'équilibre. K est la constante d'équilibre, l'indice b indique que ceci est une expression constante d'équilibre pour une base faible, et les parenthèses indiquent des concentrations molaires.
Calcul équilibre de solubilité Problèmes
La équation de produit de solubilité est utilisé pour décrire la situation d'équilibre lorsqu'on désire un sel non-ainsi-soluble se dissout dans l'eau. Pour la dissociation générale d'un sel peu soluble:

Dans cette équation, X+ et z- sont l'ampleur de la charge positive et négative, respectivement- l'expression constante d'équilibre (de l'expression du produit de solubilité) est
Ksp = [MX+]un[Xz-]b
La lutte contre la thermodynamique Problèmes
La Énergie libre de Gibbs est le meilleur indicateur pour savoir si une réaction sera spontanée ou nonspontaneous. Vous aurez besoin de savoir ce que vous étudiez Chimie II. Elle a la forme:
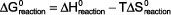
Dans cette équation, Delta-G ° est l'Gibbs gratuit énergie d'une réaction dans des conditions standard de 1 atm (ou 1 bar) pour les gaz et 1 M pour les solutions à 25 ° C Delta-H ° est l'enthalpie de la réaction dans des conditions- T est la norme en température Kelvin et Delta-S ° est l'entropie de la réaction dans des conditions standard.
Un processus spontané a ° G lt; 0. Un processus a nonspontaneous Delta-G> 0. Lorsque ° G = 0, le processus est à l'équilibre.






