Le calcul de l'échange de chaleur dans un système clos
En physique, que vous pouvez calculer combien d'énergie de chaleur nécessaire pour élever un objet de masse par une certaine une certaine température - tout ce que vous avez besoin est la chaleur spécifique de l'objet.
A une température donnée, différents matériaux peuvent contenir différentes quantités d'énergie thermique. Par exemple, si vous réchauffer une pomme de terre, il peut tenir plus longtemps sa chaleur (comme votre langue peut en témoigner) d'un matériau plus léger comme la barbe à papa. Pourquoi? Parce que les magasins de pommes de terre plus d'énergie thermique pour un changement donné dans en température par conséquent, plus de chaleur doit circuler pour refroidir la pomme de terre que ce qui est nécessaire pour refroidir la barbe à papa. La mesure de la quantité de chaleur nécessaire pour élever la température d'un objet d'une masse donnée un nombre donné de degrés est appelé son la chaleur spécifique.
Supposons que vous voyez quelqu'un faire un pot de café. Vous mesurez exactement 1,0 kg de café moulu dans le pot, puis vous descendez aux mesures réelles. Vous trouvez que vous avez besoin de 4,186 joules d'énergie thermique pour élever la température du café par 1 degré Celsius, mais vous avez seulement besoin de 840 joules pour élever 1,0 kg de verre de 1 degré Celsius- le café et le verre ont des chaleurs spécifiques. L'énergie thermique entre dans la substance étant chauffé, qui stocke l'énergie sous forme d'énergie interne jusqu'à ce qu'il coule à nouveau. (Note: Si vous avez besoin pour élever 4,186 joules 1,0 kg de café par 1 degré Celsius, vous devez double, 8,372 joules, pour élever 2,0 kg de café par 1 degré Celsius ou soulèvent 1,0 kg de café par 2 degrés Celsius.)
L'équation suivante concerne la quantité de chaleur nécessaire pour élever la température d'un objet à la variation de la température et de la quantité de masse impliqués:
Ici, Q est la quantité d'énergie de chaleur transférée dans l'objet (mesurée en joules si vous utilisez la MKS, ou au mètre-kilogramme-seconde au système), m est la masse de l'objet,
(mesurée en degrés Celsius ou en degrés Kelvin), et c est une constante appelée chaleur spécifique, qui est mesurée en joules par kilogramme degrés Celsius,
Habituellement physiciens calculer la chaleur spécifique par l'expérimentation, donc la plupart des problèmes vous donnent c ou vous référer à un tableau de valeurs de chaleur spécifique pour divers matériaux.
Vous pouvez utiliser l'équation de la chaleur pour savoir comment la température change lorsque vous mélangez des liquides de différentes températures. Supposons que vous avez 45 grammes de café dans votre tasse, mais il refroidi pendant que vous étiez déterminer la chaleur spécifique du café. Vous appelez sur votre hôte. Le café est de 45 degrés Celsius, mais vous l'aimez à 65 degrés Celsius. L'hôte se lève pour verser un peu plus. “ Juste une minute, ” tu dis. “ Le café dans le pot est de 95 degrés Celsius. Attendez que je calculer exactement combien vous avez besoin pour verser ”.
L'équation suivante représente la chaleur perdue par la nouvelle masse de café, m1:
Et voici la chaleur acquise par le café, la masse existante m2:
En supposant que vous avez une tasse de café superisolantes, aucune énergie quitte le système à l'extérieur, et parce que l'énergie ne peut pas être créée ou détruite, l'énergie est conservée dans un tel Système- fermée par conséquent, la chaleur perdue par le nouveau café est la chaleur que l'actuel gains de café, de sorte
Par conséquent, vous pouvez dire ce qui suit:
cm1(T - T10) = -cm2(T - T2,0)
En divisant les deux côtés par la chaleur spécifique de café, c, et en branchant les chiffres que vous donne ce qui suit:
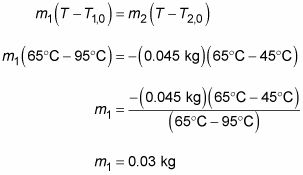
Vous avez besoin de 0,03 kg, ou 30 grammes. Satisfait, vous rangez votre calculatrice et dites, “ Donne-moi exactement 30 grammes de ce café ”.






