Calculer des masses moléculaires en utilisant des points de solvants ébullition et de congélation
Une solide compréhension de molalité vous aide à calculer les changements en ébullition et de congélation points. De la même manière, une solide compréhension de l'élévation du point d'ébullition et de congélation abaissement du point peut vous aider à déterminer la masse moléculaire d'un composé de mystère qui est ajoutée à une quantité connue de solvant.
Point d'ébullition élévation
fait référence à la tendance de la température d'ébullition du solvant à augmenter quand une impureté (soluté) est ajouté. Abaissement du point de congélation
fait référence à la tendance du point de congélation d'un solvant pour diminuer quand une impureté est ajoutée.
Lorsque vous êtes invité à résoudre des problèmes de ce type, vous serez toujours donné la masse du soluté de mystère, la masse de solvant, et soit le changement dans le point de congélation ou l'ébullition ou le nouveau gel ou point d'ébullition lui-même. De cette information, vous suivez alors un ensemble de mesures simples pour déterminer la masse moléculaire:
Trouver l'élévation du point d'ébullition ou congélation abaissement du point.
Si vous avez reçu le point d'ébullition, calculer la
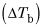
en soustrayant le point du solvant pur d'ébullition à partir du numéro vous a été donné. Si vous connaissez le point de congélation, il faut soustraire le point du solvant pur de congélation à elle pour obtenir le
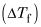
Cherchez le Kb ou KF du solvant (voir les tableaux ci-dessous la liste).
Résoudre pour la molalité de la solution en utilisant l'équation pour
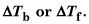
Calculer le nombre de moles de soluté dans la solution en multipliant la molalité calculé à l'étape 3 par le nombre donné de kg de solvant.
Diviser la masse de soluté donné par le nombre de moles calculé à l'étape 4.
Ceci est votre masse moléculaire, ou le nombre de grammes par mole, à partir de laquelle vous pouvez souvent deviner l'identité du composé de mystère.
| Solvant | Kb en degrés C /m | Point d'ébullition en degrés C |
|---|---|---|
| Acide acétique | 3.07 | 118.1 |
| Benzène | 2.53 | 80,1 |
| Camphre | 5.95 | 204,0 |
| Le tétrachlorure de carbone | 4,95 | 76,7 |
| Cyclohexane | 2.79 | 80,7 |
| Éthanol | 1.19 | 78,4 |
| Phénol | 3.56 | 181,7 |
| Eau | 0,512 | 100,0 |
| Solvant | KF en degrés C /m | Point de congélation en degrés C |
|---|---|---|
| Acide acétique | 3.90 | 16,6 |
| Benzène | 5.12 | 5.5 |
| Camphre | 37,7 | 179,0 |
| Le tétrachlorure de carbone | 30,0 | -23,0 |
| Cyclohexane | 20,2 | 6.4 |
| Éthanol | 1.99 | -114,6 |
| Phénol | 7,40 | 41,0 |
| Eau | 1.86 | 0.0 |
Ici'un exemple: 97,30 g d'un composé de mystère est ajouté à 500,0 g d'eau, élever son point d'ébullition à 100,78 degrés C. Quelle est la masse moléculaire du composé de mystère?
Première soustraire le point d'ébullition d'eau à partir de ce nouveau point d'ébullition:
Ensuite, branchez cette valeur et un Kb de 0,512 dans l'équation pour l'élévation du point d'ébullition et à résoudre pour molalité:
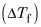
Ensuite, prenez cette valeur de molalité et le multiplier par la masse donnée du solvant, de l'eau, en kilogrammes:
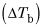
Dernière, divisez le nombre de grammes de soluté de mystère par le nombre de moles, en vous donnant la masse moléculaire du composé:
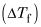
La masse moléculaire du composé de mystère est 130 g / mol.






