Comment calculer la formule empirique d'un composé
Si vous ne connaissez pas la formule empirique d'un composé, vous pouvez analyser des échantillons du composé inconnu pour identifier la composition de pour cent. De là, vous calculez les rapports des différents types d'atomes dans le composé. Vous exprimez ces rapports que la formule empirique.
Une formule empirique représente le meilleur rapport l'ensemble du nombre d'éléments dans un composé.
Voici comment faire pour trouver une formule empirique quand donné la composition de pour cent:
Supposons que vous avez 100 g du composé inconnu.
La beauté de ce petit truc est que vous vous commodément cadeau avec le même nombre de grammes de chaque composant élémentaire comme sa contribution à la composition pour cent. Par exemple, si vous supposez que vous avez 100 g d'un composé composé de 60,3% de magnésium et 39,7% d'oxygène, vous savez que vous avez 60,3 g de magnésium et 39,7 g d'oxygène. (Le seul moment où vous ne faites pas cela le problème est que si vous donne précisément les masses de chaque élément présent dans le composé inconnu.)
Traduire les masses de l'étape 1 en moles en utilisant la masse molaire.
Déterminer quel élément a la valeur molaire plus petit. Puis diviser toutes les valeurs molaires vous avez calculé à l'étape 2 par cette petite valeur.
Cette répartition donne les rapports molaires des éléments du composé.
Si l'un de vos rapports molaires sont pas des nombres entiers, tous les numéros multiplier par le facteur le plus petit possible qui produit des rapports molaires de nombre entier pour tous les éléments.
Par exemple, si vous avez 1 atome d'azote pour chaque 0,5 atomes d'oxygène dans un composé, la formule empirique est pas N1O0,5. Une telle formule suggère désinvolture qu'un atome d'oxygène a été divisé, ce qui créerait une explosion nucléaire à petite échelle. Bien sondage impressionnante, ce scénario est presque certainement fausse. Loin est plus probable que les atomes d'azote et d'oxygène se combinent dans un 1: 0,5 rapport mais le faire dans un rapport plus grand, mais équivalent de 2: 1. La formule empirique est donc N2O.
Parce que les données d'origine de composition pour cent est généralement expérimentale, attendre à voir un peu d'erreur dans les chiffres. Par exemple, 2,03 est probablement à l'intérieur de l'erreur expérimentale de deux, est probablement 2,99 3, et ainsi de suite.
Ecrire la formule empirique en attachant ces ratios molaires de nombre entier comme des indices sur le symbole chimique de chaque élément.
Commandez les éléments selon les règles générales pour nommer les composés ioniques et moléculaires.
Voici un exemple: Quelle est la formule empirique d'une substance qui est 40,0% de carbone, 6,7% d'hydrogène et 53,3% d'oxygène en masse?
Par souci de simplicité, supposons que vous avez un total de 100 g de ce composé de mystère. Par conséquent, il faut 40,0 g de carbone, 6,7 g d'un atome d'hydrogène, et 53,3 g d'oxygène. Autre chacune de ces masses à l'aide des moles par gramme masses atomiques du C, H, et O:
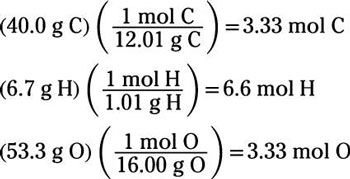
Notez que les numéros molaires carbone et d'oxygène sont les mêmes, si vous connaissez le rapport de ces deux éléments est de 1: 1 dans l'enceinte. Ensuite, diviser tous les nombres de moles par le plus petit d'entre eux, qui est de 3,33. Cette division rendements
Le composé répond à la formule empirique CH2O. Le nombre réel d'atomes au sein de chaque particule du composé est un multiple des nombres exprimés dans cette formule.






