Comment effectuer des conversions à partir d'équations équilibrées taupe taupe
Vous pouvez équilibrer une équation chimique en ajustant les coefficients qui précèdent réactifs et des produits composés dans l'équation. Après vous avez une équation équilibrée, vous pouvez utiliser les coefficients de construire facteurs de conversion taupe Mole. Ces types de facteurs de conversion vous dire combien de tout produit donné vous obtenez en faisant réagir toute quantité donnée de réactif.
Considérons l'équation équilibrée suivante pour générer de l'ammoniac à partir de gaz azote et d'hydrogène:
Chimistes industriels du monde entier effectuent cette réaction, fixateur sans humour sur la façon dont beaucoup d'ammoniaque produit qu'ils vont se retrouver avec à la fin de la journée. En tout état de cause, comment sont les chimistes de juger dans quelle mesure leurs réactions ont approché l'achèvement? Le cœur de la réponse réside dans une équation équilibrée et les facteurs de conversion taupe taupe qui en dérivent.
Pour chaque mole de réactif d'azote, un chimiste attend produit 2 moles d'ammoniac. De même, pour tous les 3 moles de réactif d'hydrogène, le chimiste attend 2 moles de produit de l'ammoniac. Ces projections sont basées sur les coefficients de l'équation équilibrée et sont exprimés en tant que facteurs de conversion molaires moles, comme indiqué sur la figure.
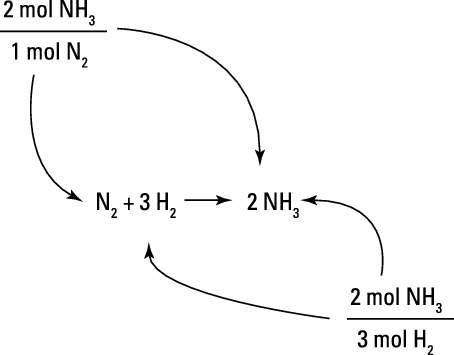
Par exemple, disons que vous voulez calculer le nombre de moles d'ammoniac peuvent être attendus de la réaction de 278 moles de N2 gaz.
Pour résoudre ce problème, vous commencez avec votre quantité connue, le 278 mol d'azote qui est à faire réagir. Vous multipliez cette quantité par le facteur de conversion taupe taupe qui concerne moles d'azote moles d'ammoniac. Vous écrivez le facteur de conversion de telle sorte que mol NH3 est sur le dessus et mol N2 est sur le fond. De cette façon, la mol N2 unités annulent, vous laissant avec les unités désirées, mol NH3. Les chiffres que vous mettez en face des unités pour le facteur de conversion proviennent directement des coefficients dans l'équation chimique équilibrée.

Donc, vous vous attendez 556 mol d'ammoniac à partir de la réaction.
Essayez un autre exemple. Une source de gaz d'hydrogène est l'électrolyse de l'eau, dans laquelle l'électricité est passé à travers l'eau pour rompre les liaisons hydrogène-oxygène, produisant des gaz d'hydrogène et d'oxygène:
Selon cette équation, résoudre ces trois problèmes:
Combien de moles de résultat de gaz d'hydrogène par électrolyse de 78,4 mol d'eau?
Gardez à l'esprit que le numéro que vous utilisez pour les taupes est le coefficient pour le composé tiré de la réaction chimique équilibrée:
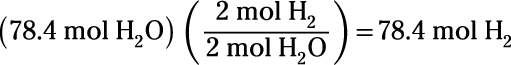
Vous trouvez que la réaction d'électrolyse produit 78,4 moles de gaz d'hydrogène.
Combien de moles d'eau sont nécessaires pour produire 905 moles de l'hydrogène?
Pour trouver les moles d'eau produite, vous appliquez à nouveau une conversion-taupe mole:
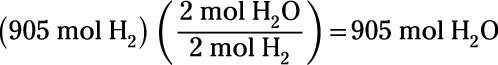
Ceci montre que la réaction produit 905 moles d'eau.
L'exécution de la réaction d'électrolyse en sens inverse constitue la combustion de l'hydrogène. Combien de moles d'oxygène requis pour la combustion sont de 84,6 moles d'hydrogène?
Enfin, vous courez la réaction d'électrolyse dans le sens inverse:
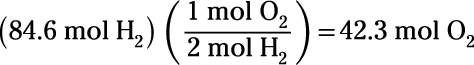
Cela montre que 42,3 moles d'oxygène sont requis pour brûler 84,6 moles d'hydrogène.






