Comment calculer les concentrations pour préparer les dilutions
Chimistes de la vie réelle dans les laboratoires de la vie réelle ne font pas toute solution à partir de zéro. Au lieu de cela, ils font concentrés des solutions d'achat d'actions et ensuite faire dilutions de ces stocks comme nécessaires pour une expérience donnée.
Pour faire une dilution, il suffit d'ajouter une petite quantité d'une solution de réserve concentrée à une quantité de solvant pur. La solution résultante contient la quantité de soluté prise à l'origine de la solution de stock, mais se disperse que soluté à travers un plus grand volume. Par conséquent, la concentration finale est-inférieur de la solution finale est moins concentré et plus dilué.
Comment savez-vous combien de la solution de réserve à utiliser et la quantité de solvant pur à utiliser? Il dépend de la concentration du stock et sur la concentration et le volume de la solution finale que vous voulez. Vous pouvez répondre à ce genre de questions pressantes en utilisant l'équation de dilution, qui concerne la concentration (C) et le volume (V) entre états initiaux et finaux:
C1V1 = C2V2
Vous pouvez utiliser l'équation de dilution avec toutes les unités de concentration, à condition d'utiliser les mêmes unités à travers le calcul. Parce que la molarité est telle manière commune pour exprimer la concentration, l'équation de dilution est parfois exprimée de la manière suivante, où M1 et M2 se référer à la molarité initial et final, respectivement:
M1V1 = M2V2
Par example, comment voulez-vous préparer 500. ml de 0,200 M NaOH (aq) À partir d'une solution de réserve de 1,5 M NaOH?
Commencer en utilisant l'équation de dilution,
M1V1 = M2V2
La molarité initiale, M1, vient de la solution de stock et est donc 1,5 M. La molarité finale est celle que vous voulez dans votre solution finale, qui est 0,200 M. Le volume final est celui que vous voulez pour votre solution finale, 500. mL, ce qui équivaut à 0,500 L. En utilisant ces valeurs connues, vous pouvez calculer le volume initial, V1:
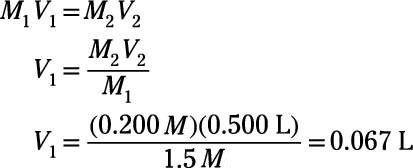
Le volume calculé est équivalent à 67 ml. Le volume final de la solution aqueuse est de 500 ml, soit 67 ml et de ce volume provient de la solution mère. Le reste, 500 ml - 67 ml = 433 ml, vient de solvant pur (eau, dans ce cas). Ainsi, pour préparer la solution, ajouter 67 ml de 1,5 M solution stock à 433 ml d'eau. Mélangez et faites vous plaisir!
Try un autre problème: Quelle est la concentration finale en molarité d'une solution préparée en diluant 2,50 ml de 3,00 M KCl (aq) Jusqu'à 0,175 L volume final?
Vous pouvez utiliser l'équation de dilution,
M1V1 = M2V2
En ce problème, la molarité initiale est de 3,00 M, le volume initial est de 2,50 ml ou 2,50 x 10-3 L et le volume final est de 0,175 L. utilisation de ces Les valeurs connues pour calculer la molarité finale, M2:
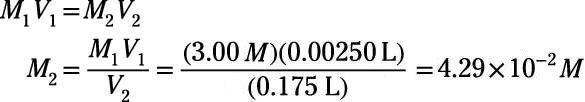
Ainsi, la concentration finale dans la solution de molarité est
4,29 x 10-2 M






