Identifier les buts, objectifs, hypothèses et variables pour une étude clinique
La objectifs ou buts d'une étude sont des énoncés généraux courtes (souvent juste une déclaration) de l'objectif global de l'essai. Par exemple, le but d'une étude peut être "pour évaluer l'innocuité et l'efficacité du médicament chez les patients avec XYZ hyperlipidémie modérée."
La objectifs sont beaucoup plus précis que les objectifs. Objectifs réfèrent généralement à l'effet du produit sur les variables de sécurité et d'efficacité spécifiques, à des points spécifiques dans le temps, dans des groupes spécifiques de sujets. Une étude d'efficacité peut avoir de nombreux objectifs d'efficacité individuels, ainsi que un ou deux sécurité objectifs- une étude de sécurité peuvent ou non avoir des objectifs d'efficacité.
Vous devez identifier un ou deux objectifs primaires - ceux qui sont les plus directement liée à l'objectif de l'étude et de déterminer si le produit réussit ou échoue dans l'étude. Vous pouvez ensuite identifier jusqu'à plusieurs dizaines objectifs secondaires, qui peut comprendre plusieurs variables ou les mêmes variables à différents points dans le temps ou dans les différents sous-ensembles de la population de l'étude.
Vous pouvez aussi lister un ensemble de objectifs exploratoires, qui sont moins importants, mais toujours intéressant. Enfin, vous listez un ou plusieurs objectifs de sécurité (si cela est une étude d'efficacité) ou certains objectifs d'efficacité (si cela est une étude de sécurité).
Un ensemble typique de primaire, secondaire, exploratoire, et les objectifs de sécurité (cet exemple montre un de chaque type) pour une étude d'efficacité pourrait ressembler à ceci:
Objectif principal d'efficacité: Pour comparer l'effet du médicament XYZ, par rapport au placebo, sur les changements dans le taux de cholestérol total dans le sérum de ligne de base à 12 semaines, chez des patients atteints d'hyperlipidémie modérée.
Objectif secondaire d'efficacité: Pour comparer l'effet de la drogue XYZ, par rapport au placebo, sur les changements dans le total des taux de cholestérol sérique et de triglycérides sériques de base à quelques semaines 4 et 8, chez les patients atteints d'hyperlipidémie modérée.
Objectif d'efficacité exploratoire: Pour comparer l'effet de la drogue XYZ, par rapport au placebo, sur les changements dans les lipides sériques de base à des semaines 4, 8, et 12, dans des sous-ensembles mâles et femelles de patients présentant une hyperlipidémie modérée.
Objectif de sécurité: Pour évaluer l'innocuité du médicament XYZ, par rapport au placebo, en termes de survenue d'événements indésirables, des changements de base dans les signes vitaux (tension artérielle et du rythme cardiaque), et les résultats de laboratoire de sécurité (chimie, hématologie, et ainsi de suite), en les patients présentant une hyperlipidémie modérée.
Hypothèses correspondent généralement aux objectifs, mais sont rédigés d'une manière qui se rapporte directement à la tests statistiques à effectuer. Donc, l'objectif principal qui précède peut correspondre à l'hypothèse suivante: "La réduction moyenne de 12 semaines du cholestérol total sera plus grande dans le groupe XYZ que dans le groupe placebo."
Alternativement, l'hypothèse peut être exprimée dans une notation mathématique plus formelle et comme une paire nulle et alternative:
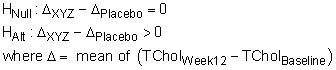
Identifier les variables à collecter dans votre étude devrait être simple après que vous avez énuméré tous les objectifs. Généralement, vous devez planifier sur la collecte de certains ou de tous les types de données suivants:
Données démographiques de base (comme la date de naissance, le sexe, la race et l'origine ethnique)
Informations sur la participation du sujet à l'étude (par exemple, la date d'inscription, si le sujet a rencontré chaque inclusion et le critère d'exclusion, date de chaque visite, les mesures de mise en conformité, et le statut final (complète, se retira, perdu pour le suivi et etc.)
Les mesures de base de base (taille, poids, signes vitaux, des tests de laboratoire de sécurité, etc.)
Objet et les antécédents médicaux de la famille, y compris les maladies, les hospitalisations, le tabagisme et d'autres substances, et les médicaments actuels et passés
De laboratoire et autres tests (ECG, radiographies, etc.) des résultats liés aux objectifs de l'étude
Les réponses des questionnaires et d'autres évaluations subjectives
Survenue d'événements indésirables
Certaines de ces informations doit être enregistré qu'une seule fois (comme la date de naissance, le sexe, et l'histoire de la famille) - autres informations (telles que les signes vitaux, dosage, et les résultats des tests) peuvent être acquis lors des visites programmée ou non, et certains peuvent être enregistrés qu'une seule à des moments imprévisibles, voire pas du tout (comme événements indésirables).
Pour les études très simples, vous pourriez être en mesure d'enregistrer toutes vos données sur une seule feuille (quoique large) de papier quadrillé, avec une ligne pour chaque sujet et une colonne pour chaque variable. Mais dans les études cliniques formelles, vous devez concevoir un Case Formulaire de rapport (CRF). Une CRF est souvent un livret ou un liant avec une page pour les données une seule fois et un ensemble de pages identiques pour chaque type de données récurrentes.
Beaucoup d'excellents modèles CRF peuvent être téléchargés à partir du Web (ou entrer simplement «modèles de CRF" dans votre navigateur).

