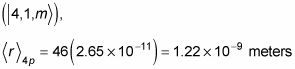Calculer la distance d'un électron du proton d'un atome d'hydrogène
Lorsque vous voulez trouver où un électron est à un moment donné dans un atome d'hydrogène, ce que vous faites réellement est de trouver dans quelle mesure l'électron est du proton. Vous pouvez trouver la valeur moyenne de r, c'est,
l'expression suivante représente la probabilité que l'électron se trouve dans l'élément spatial ré3r:
En coordonnées sphériques,
Donc vous pouvez écrire
comme
La probabilité que l'électron se trouve dans une coque sphérique de rayon r à r + dr est donc
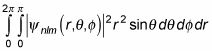
Et parce que
cette équation devient la suivante:
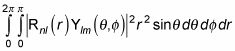
L'équation précédente est égal à
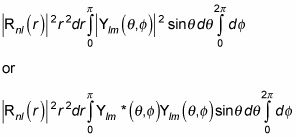
(Rappelez-vous que le symbole astérisque désigne le complexe conjugué. Un conjugué complexe retourne le signe reliant les parties réelle et imaginaire d'un nombre complexe).
Les harmoniques sphériques sont normalisées, de sorte que cela devient juste
D'accord, ça la probabilité que l'électron est à l'intérieur de l'enveloppe sphérique r à r + dr. Ainsi, la valeur moyenne de r, qui est
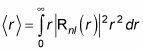
qui est
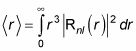
Ceci est où les choses deviennent plus complexes, parce que Rnl(r) Implique les polynômes de Laguerre. Mais après beaucoup de maths, voici ce que vous obtenez:
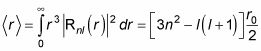
où r0 est le rayon de Bohr:
Le rayon de Bohr est d'environ
de sorte que la valeur moyenne de la distance de l'électron du proton est
Ainsi, par exemple, dans l'unes état
la valeur moyenne de r est égal à
Et dans la 4p état